题目内容
17.按从小到大的顺序排列以下各组物质:A、按离子极化大小排列MnCl2,ZnCl2,NaCl,CaCl2ZnCl2>MnCl2>CaCl2>NaCl;
B、按键的极性大小排列NaCl,HCl,Cl2,HINaCl>HCl>HI>Cl2.
分析 A.阳离子电荷越高,半径越小,则极化作用越强;
B.电负性相差越大,键的极性越大.
解答 解:A.阳离子电荷越高,半径越小,则极化作用越强,则按离子极化大小排列为ZnCl2>MnCl2>CaCl2>NaCl;
故答案为:ZnCl2>MnCl2>CaCl2>NaCl;
B.电负性相差越大,键的极性越大,则按键的极性大小排列为NaCl>HCl>HI>Cl2;
故答案为:NaCl>HCl>HI>Cl2.
点评 本题考查了离子极化和键的极性的判断,题目难度中等,把握比较规律是解题的关键,侧重于考查学生的分析能力和对基本规律的应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.将m g Al2O3、Fe2O3的混和物溶解在过量的100mL0.05mol/L的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
| A. | 0.1mol/L | B. | 0.05mol/L | C. | 0.2mol/L | D. | 无法计算 |
5.在0.1mol•L-1的NaHCO3溶液中,下列关系式正确的是( )
| A. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | ||
| C. | c(Na+)=c(HCO3-)>c(OH-)>c(H+) | D. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) |
12.下列说法中正确的是( )
| A. | 植物油和裂化汽油都能使溴水褪色 | |
| B. | 葡萄糖、蔗糖都能与新制的Cu(OH)2悬浊液发生氧化反应 | |
| C. | 淀粉、油脂、氨基酸都能水解,但水解产物不同 | |
| D. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔沸点 |
2.证明一瓶乙醛溶液部分被氧化的化学试剂是( )
| A. | 银氨溶液 | B. | 金属钠 | C. | NaHCO3溶液 | D. | 酚酞溶液 |
6.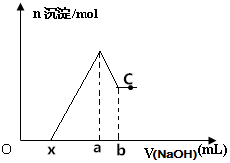 将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )
将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )
 将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )
将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )| A. | C点对应的沉淀为Mg(OH)2 | |
| B. | Al的质量为27(b-a)×10-3 | |
| C. | 该合金与盐酸反应产生的H2为(a-x)×10-3mol | |
| D. | 由图可以确定x的取值范围为:0≤x<(4a-3b) |
10.丙烯醛(结构简式为CH2=CH-CHO)能发生的化学反应有( )
①加成 ②消除(消去) ③取代 ④氧化 ⑤还原 ⑥加聚 ⑦缩聚.
①加成 ②消除(消去) ③取代 ④氧化 ⑤还原 ⑥加聚 ⑦缩聚.
| A. | ①③⑤⑦ | B. | ②④⑥ | C. | ①④⑤⑥ | D. | ③④⑤⑥ |
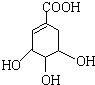 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如下:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如下: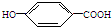 ),其反应类型是消去反应,化学方程式是
),其反应类型是消去反应,化学方程式是 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$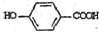 +2H2O.
+2H2O. .
.