题目内容
10.原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2的离子化合物.(1)写出Y2O2的电子式:
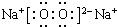 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.(2)用电子式表示Y2O的形成过程
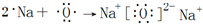 .
.(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是HNO3(填化学式).
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是NH3(填化学式).
(5)由X、W组成的化合物分子中.X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式NCl3+3H2O=NH4ClO+2HClO.
分析 原子序数由小到大排列的四种短周期元素X、Y、Z、W,Y与氧元素可组成Y2O和Y2O2的离子化合物,Y为Na,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物,可知X为N,Z为S,W为Cl,
(1)Y2O2为Na2O2,含离子键、共价键;
(2)Na2O为离子化合物;
(3)X、Z、W三种元素的最高价氧化物对应的水化物,分别为硝酸、硫酸、高氯酸;
(4)氨气与硫化氢、HCl均反应;
(5)X、W原子的最外层均达到8电子稳定结构,该化合物为NCl3,遇水可生成一种具有漂白性的化合物为HClO,以此来解答.
解答 解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,Y与氧元素可组成Y2O和Y2O2的离子化合物,Y为Na,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物,可知X为N,Z为S,W为Cl,
(1)Y2O2为Na2O2,电子式为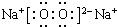 ,含离子键、共价键,
,含离子键、共价键,
故答案为: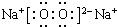 ;离子键、共价键;
;离子键、共价键;
(2)Na2O为离子化合物,用电子式表示形成过程为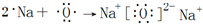 ,
,
故答案为: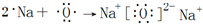 ;
;
(3)X、Z、W三种元素的最高价氧化物对应的水化物,分别为硝酸、硫酸、高氯酸,稀溶液中只有HNO3具有强氧化性,
故答案为:HNO3;
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是NH3,故答案为:NH3;
(5)X、W原子的最外层均达到8电子稳定结构,该化合物为NCl3,遇水可生成一种具有漂白性的化合物为HClO,该反应为NCl3+3H2O=NH4ClO+2HClO,
故答案为:NCl3+3H2O=NH4ClO+2HClO.
点评 本题考查位置、结构及性质的应用,为高频考点,把握元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
7.NA为阿伏加德罗常效,下列叙述错误的是( )
| A. | 18g H2O中含有的质子数为10NA | |
| B. | 1L0.1mol/LAl2(SO4)3溶液中,Al3+的数目为0.2NA | |
| C. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
4.MgSO4和Al2(SO4)3溶液等体积混合后,Al3+浓度为0.1mol/L.SO42-浓度为0.3mol/L,则混合溶液中Mg2+浓度为( )
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.45mol/L | D. | 0.2mol/L |
5.五种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)请写出元素名称:X碳Y氮W氯;
(2)元素Z位于周期表中第三周期ⅢA族;
(3)写出X单质与Y的最高价氧化物水化物浓溶液在受热时反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;M的最高价氧化物的水化物化学式为HClO4.
| X | Y | ||
| Z | W | M |
(1)请写出元素名称:X碳Y氮W氯;
(2)元素Z位于周期表中第三周期ⅢA族;
(3)写出X单质与Y的最高价氧化物水化物浓溶液在受热时反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;M的最高价氧化物的水化物化学式为HClO4.
20.在某碱性溶液中,能共存的离子组是( )
| A. | Na+、Ba2+、Cl-、NO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、HCO3- | D. | Al3+、K+、SO42-、Cl- |
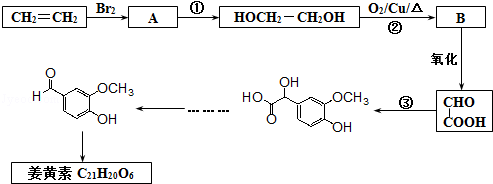
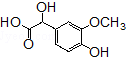 的含氧官能团的名称为醚键和羧基、羟基
的含氧官能团的名称为醚键和羧基、羟基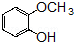
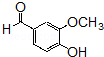 的同分异构体的结构简式
的同分异构体的结构简式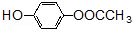
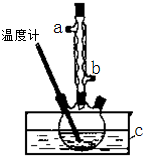 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去):
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去): )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:



 .
. ,C中含有的含氧官能团的名称为硝基和羧基.
,C中含有的含氧官能团的名称为硝基和羧基. .
. (任写一种).
(任写一种).