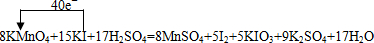题目内容
19.有K2SO4和Al2(SO4)3的混合溶液,已知其中K+的物质的量浓度为0.2mol/L,SO42-的物质浓度为0.7mol/L,则此溶液中Al3+的物质的量的浓度为( )| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
分析 根据溶液呈电中性原则,溶液中应满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),以此结合题中数据进行解答.
解答 解:溶液呈电中性,则满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),
由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),
则:3c(Al3+)+0.2mol/L=2×0.7mol/L,
所以溶液中铝离子浓度为:3c(Al3+)=2×0.7mol/L-0.2mol/L=1.2mol/L,故c(Al3+)=0.4mol/L.
故选D.
点评 本题考查混合溶液中离子物质的量浓度的计算,题目难度中等,注意溶液中离子浓度计算中电荷守恒的运用,明确物质的量浓度的概念及计算方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9. 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )| A. | 最初20 mLNaOH溶液用于中和过量的硫酸 | |
| B. | 20-200 mL过程中:溶液中发生两个沉淀反应 | |
| C. | 200-240 mL过程中:溶液中只发生Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 生成的氢气在标准状况下的体积为11.2 L |
7.NA为阿伏加德罗常效,下列叙述错误的是( )
| A. | 18g H2O中含有的质子数为10NA | |
| B. | 1L0.1mol/LAl2(SO4)3溶液中,Al3+的数目为0.2NA | |
| C. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
14.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
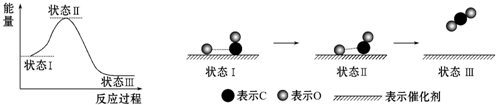
下列说法中正确的是( )

下列说法中正确的是( )
| A. | CO和O生成CO2是吸热反应 | B. | 状态Ⅰ→状态Ⅲ表示CO和O反应的过程 | ||
| C. | CO和O生成了具有非极性键的CO2 | D. | 在该过程中,CO断键形成C和O |
4.MgSO4和Al2(SO4)3溶液等体积混合后,Al3+浓度为0.1mol/L.SO42-浓度为0.3mol/L,则混合溶液中Mg2+浓度为( )
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.45mol/L | D. | 0.2mol/L |
5.五种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)请写出元素名称:X碳Y氮W氯;
(2)元素Z位于周期表中第三周期ⅢA族;
(3)写出X单质与Y的最高价氧化物水化物浓溶液在受热时反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;M的最高价氧化物的水化物化学式为HClO4.
| X | Y | ||
| Z | W | M |
(1)请写出元素名称:X碳Y氮W氯;
(2)元素Z位于周期表中第三周期ⅢA族;
(3)写出X单质与Y的最高价氧化物水化物浓溶液在受热时反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;M的最高价氧化物的水化物化学式为HClO4.