题目内容
9.下列叙述中正确的是( )| A. | NH3、CO、CO2都是极性分子 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | 分子晶体熔点越高,其稳定性越增强 | |
| D. | CS2、H2O、C2H2都是直线形分子 |
分析 A.结构对称,正负电荷的中心重合,则为非极性分子;
B.由不同种非金属元素的原子间易形成的极性共价键;
C.共价键越强,分子越稳定;
D.H2O是V形分子.
解答 解:A.CO2是直线结构,结构对称,正负电荷的中心重合,为非极性分子,NH3、CO为极性分子,故A错误;
B.CH4、CCl4都含有极性键,二者的分子结构都是正四面体,结构对称,正负电荷的中心重合,为非极性分子,故B正确;
C.共价键越强,分子越稳定,分子的稳定性与熔点无关,故C错误;
D.H2O分子中含有2个孤电子对,分子构型是V形,CS2、C2H2都是直线形分子,故D错误.
故选B.
点评 本题考查化学键的极性、分子极性,题目难度不大,明确化学键、分子极性判断的方法是解答本题的关键,注意熟悉常见分子的构型,试题培养了学生灵活应用所学知识解决实际问题的能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
19.可以在实验室安全快速制取氨气的方法是( )
| A. | 在浓氨水中加固体NaOH | B. | 混合NH4Cl溶液和NaOH溶液 | ||
| C. | 加热分解NH4Cl晶体 | D. | 加热消石灰和NH4NO3的固体混合物 |
17.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | l mol羟基含有的电子数为9NA | |
| B. | 常温下,l mol乙烯和乙硼烷(B2H6)的混合气体所含的电子数为16NA | |
| C. | l mol苯乙烯中含有的碳碳双键数为4NA | |
| D. | 26 g乙炔和苯蒸气的混合气体中所含的碳原子数为2NA |
4.下列化合物分子中的所有原子都处于同一平面的是( )
| A. | 溴苯 | B. | 乙醛 | C. | 四氯化碳 | D. | 丙烯 |
14.下列说法正确的是( )
| A. | 室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| B. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 向苯酚钠溶液中通入少量CO2,溶液变浑浊,反应为:2C6H5ONa+CO2→2C6H5OH+Na2CO3 |
1.下列化学用语正确的是( )
| A. | 苯的最简式:C6H6 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 2-乙基-1,3-丁二烯分子的键线式: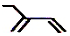 |
18.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 向稀硝酸中加入少量铁粉 | 有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色胶状物质 | H2CO3的酸性比H2SiO3的酸性强 |
| D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | NaHCO3为难溶物 |
| A. | A | B. | B | C. | C | D. | D |