题目内容
19.一定量的浓H2SO4与Zn反应,当Zn完全溶解时,生成气体的体积为20.16L(S.T.P).将所得气体通过足量稀硝酸,余下气体15.68L(S.T.P).(1)求参加反应的Zn的物质的量.
(2)求原来所生成气体的物质的量组成.
分析 锌与浓硫酸发生:Zn+2H2SO4═ZnSO4+SO2↑+H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4═ZnSO4+H2↑,生成气体为SO2和H2的混合物,物质的量为$\frac{20.16L}{22.4L/mol}$=0.9mol,由反应方程式可知生成混合气体1mol,参加反应的锌是1mol,将所得气体通过足量稀硝酸,发生反应的方程式为:2H2O+3SO2+2HNO3=3H2SO4+2NO,通过体积变化求原混合气体中二氧化硫的物质的量,由此分析解答.
解答 解:(1)锌与浓硫酸发生:Zn+2H2SO4═ZnSO4+SO2↑+H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4═ZnSO4+H2↑,生成气体为SO2和H2的混合物,物质的量为$\frac{20.16L}{22.4L/mol}$=0.9mol,由反应方程式可知生成混合气体1mol,参加反应的锌是1mol,
答:参加反应的Zn的物质的量为1mol;
(2)2H2O+3SO2+2HNO3=3H2SO4+2NO△n
3 1
n(SO2) $\frac{20.16-15.68}{22.4}$=0.2mol
所以 n(SO2)=3×0.2=0.6mol,则n(H2)=0.3mol,
答:原来所生成气体中含0.6mol的二氧化硫和0.3mol的氢气.
点评 本题考查化学方程式的计算,题目难度中等,本题注意以下几点:①浓硫酸与锌反应生成SO2,②随着反应的进行,硫酸的浓度降低,与锌反应生成H2,(2)根据反应的方程式利用差量的方法列式计算.

| A. | 能量守恒原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
| A. | 22.4L的CO气体1molN2所含的电子数也相等 | |
| B. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 标准情况下将2.24LCl2通入到2L水中,充分反应后转移的电子数且小于0.1NA | |
| D. | 300mL2mol•L-1蔗糖溶液中所含分子数为0.6NA |
| 容器编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| N2 | H2 | NH3 | NH3 | ||
| ① | 500 | 1 | 3 | 0 | 0.5 |
| ② | 500 | 0.6 | 1.8 | 0 | |
| ③ | 550 | 0 | 0 | 2 | a |
| A. | 容器①、②中反应的平衡常数不相等 | |
| B. | 达平衡时,容器②中H2的转化率大于25% | |
| C. | a<0.5 | |
| D. | 起始时向容器①中充入1 mol N2、2 mol H2、0.5 mol NH3,则反应将向逆反应方向进行 |
 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:(1)汽车发动机工作时会引起反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.2 000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=0.0015mol•L-1•min-1,N2的平衡转化率为0.75%,2 000 K时该反应的平衡常数K=2.25×10-4;
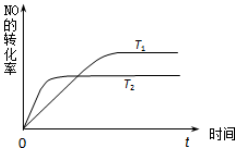
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如图所示.
①反应2NO(g)?N2(g)+O2(g)为放热反应(填“吸热”或“放热”);
②一定温度下,能够说明反应2NO(g)?N2(g)+O2(g)已达到平衡的是c(填序号);
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c.NO、N2、O2的浓度保持不变
d.单位时间内分解4mol NO,同时生成2molN2
③在四个容积和温度均完全相同的密闭容器中分别加入下列物质,相应物质的量(mo1)如表所示.相同条件下达到平衡后,N2的体积分数最大的是D(填容器代号);
| 容器代号 | NO | N2 | O2 |
| A | 2 | 0 | 0 |
| B | 0 | 1 | 1 |
| C | 0.4 | 0.6 | 0.8 |
| D | 1 | 0.5 | 0.4 |
已知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2.
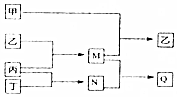 分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略).其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是( )
分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略).其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是( )| A. | 原子半径的大小m>q>n>p | |
| B. | 元素非金属性q>n>p | |
| C. | Q的溶液可以保存在细口玻璃试剂瓶 | |
| D. | n的氧化物的水化物一定为强酸 |
| A. | Al2O3$→_{△}^{H_{2}}$Al$→_{常温}^{浓H_{2}SO_{4}}$Al2(SO4)3 | |
| B. | H2SiO3$\stackrel{△}{→}$SiO2$→_{△}^{盐酸}$SiCl4 | |
| C. | SO2$\stackrel{CaCl_{2}(aq)}{→}$CaSO3$\stackrel{O_{2}}{→}$CaSO4 | |
| D. | CH3CH3$→_{光照}^{Cl_{2}}$CH3CH2Cl$→_{△}^{NaOH醇溶液}$CH2=CH2 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液,溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 在CuSO4溶液中滴加KI溶液,再加入苯,振荡,有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| D | 某溶液滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中可能不含SO42- |
| A. | A | B. | B | C. | C | D. | D |