题目内容
11.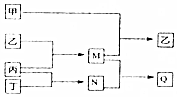 分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略).其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是( )
分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略).其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是( )| A. | 原子半径的大小m>q>n>p | |
| B. | 元素非金属性q>n>p | |
| C. | Q的溶液可以保存在细口玻璃试剂瓶 | |
| D. | n的氧化物的水化物一定为强酸 |
分析 甲为黄绿色气体,则甲为Cl2,M、N均为10电子分子且M的水溶液呈碱性,M为NH3,Q为离子化合物,N为HF,Q为NH4F,结合转化可知,乙为N2,丙为H2,丁为F2,短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,可知m为Cl,n为N,p为H,q为F,以此来解答.
解答 解:由上述分析可知,m为Cl,n为N,p为H,q为F,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径的大小m>n>q>p,故A错误;
B.同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则元素非金属性q>n>p,故B正确;
C.Q的溶液水解生成HF酸,与二氧化硅反应,不能保存在细口玻璃试剂瓶,应选塑料瓶,故C错误;
D.n为N,对应的硝酸为强酸,亚硝酸为弱酸,故D错误;
故选B.
点评 本题考查无机物的推断,为高频考点,把握图中转化、元素化合物知识推断物质为解答的关键,侧重分析与推断能力的考查,注意规律性知识及元素化合物知识的应用,选项C为易错点,题目难度不大.

练习册系列答案
相关题目
6. 某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
 某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )| A. | a 电极发生反应:H2NCH2CH2NH2+16e-+4H2O═2CO2↑+N2↑+16H+ | |
| B. | 质子交换膜处H+由右向左移动 | |
| C. | 该电池在微生物作用下将化学能转化为电能 | |
| D. | 开始放电时b极附近pH不变 |
16.W、X、Y、Z是原子序数依次最大的短周期元素,W的原子半径最小,W、Y同主族,X、Z同主族,且X、Z的原子序数之和是W、Y原子序数之和的2倍,下列说法中不正确的是( )
| A. | 由W和X两种元素形成的化合物可能含有非极性共价键 | |
| B. | 由X、Y、Z三种元素形成的化合物只能为Y2ZX2或Y2ZX4 | |
| C. | 由W、X、Y、Z四种元素形成的化合物水溶液可能呈强酸性 | |
| D. | W、X、Y、Z四种元素两两之间形成二元化合物 |
3.下列物质的性质与应用对应关系正确的是( )
| A. | 氢氟酸具有弱酸性,可用作玻璃蚀刻剂 | |
| B. | 干冰气化时吸热,可用作制冷剂 | |
| C. | 钠与水反应,可用于除去乙醇中少量的水 | |
| D. | 硅酸钠易溶于水,可用作木材防火剂 |
20.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结 论 |
| A | 取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液,溶液未呈蓝色 | 该食盐中不含有碘酸钾 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,下层溶液显紫红色 | Fe3+的氧化性大于I2 |
| C | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液,均有沉淀 | 蛋白质均发生了变性 |
| D | 将0.1mol•L-1,MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液,白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
1.下列指定反应的离子方程式正确的是( )
| A. | 用白醋除铁锈:Fe2O3•xH2O+6H+═(3+x)H2O+2Fe3+ | |
| B. | 用惰性电极电解 MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向NH4Al(SO4)2溶液中加入过量的 NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 向含NH3的污水中加入NaClO将其转化为N2:3ClO-+2NH3═3Cl-+N2↑+3H2O |