题目内容
下列说法正确的是( )
A、若完全燃烧,1mol雄酮(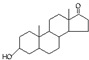 )比雌酮( )比雌酮( )多消耗3mol O2 )多消耗3mol O2 |
| B、正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 |
| C、蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应 |
| D、乙醇依次通过消去、取代、加成反应可生成乙二醇 |
考点:同分异构现象和同分异构体,乙醇的化学性质,葡萄糖的性质和用途,蔗糖、麦芽糖简介
专题:有机反应
分析:A.对比雄酮和雌酮的结构找出碳氢原子数的多少;
B.根据同分异构体沸点变化规律分析;
C.含醛基的物质能发生银镜反应;
D.乙醇消去得到乙烯,乙烯和氯气加成得到1,2-二氯乙烷,1,2-二氯乙烷水解得到乙二醇.
B.根据同分异构体沸点变化规律分析;
C.含醛基的物质能发生银镜反应;
D.乙醇消去得到乙烯,乙烯和氯气加成得到1,2-二氯乙烷,1,2-二氯乙烷水解得到乙二醇.
解答:
解:A.对比雄酮和雌酮的结构可知,雌酮苯环,雄酮不含,其余结构相同,故雄酮比雌酮多6个H原子,多消耗3mol O2,故A正确;
B.根据同分异构体沸点变化规律为支链越多沸点越低,正戊烷、异戊烷和新戊烷支链依次增多,故沸点依次降低,故B错误;
C.含醛基的物质能发生银镜反应,蔗糖不含醛基,不能发生银镜反应,故C错误;
D.乙醇消去得到乙烯,乙烯和氯气加成得到1,2-二氯乙烷,1,2-二氯乙烷水解(取代)得到乙二醇,故D错误;
故选A.
B.根据同分异构体沸点变化规律为支链越多沸点越低,正戊烷、异戊烷和新戊烷支链依次增多,故沸点依次降低,故B错误;
C.含醛基的物质能发生银镜反应,蔗糖不含醛基,不能发生银镜反应,故C错误;
D.乙醇消去得到乙烯,乙烯和氯气加成得到1,2-二氯乙烷,1,2-二氯乙烷水解(取代)得到乙二醇,故D错误;
故选A.
点评:本题考查了有机物的结构和性质,难度中等.要总结一些有机知识,比如能发生银镜反应的物质有哪些,沸点变化规律等.

练习册系列答案
相关题目
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
| B、常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA |
| C、标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA |
| D、6.8g液态KHSO4中含有0.1NA个阳离子 |
下列离子方程式表达正确的是( )
| A、等体积,等物质的量浓度的NaHCO3溶液和Ca(OH)2溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| B、FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
| C、CH3COONH4的电离:CH3COONH4?NH4++CH3COO- |
| D、苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- |
 设计如图装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法不正确的是( )
设计如图装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法不正确的是( )| A、通电后,可观察到清晰界面缓缓向上移动的原因是Cd2+向Pt电极迁移的结果 |
| B、装置中Pt电极附近的pH增大 |
| C、一定时间内,如果通过HCl溶液某一界面的总电量为5.0C,测得H+所迁移的电量为4.1C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍 |
| D、如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败 |
用NA表示阿伏加德罗常数,下列叙述中,正确的是( )
| A、常温常压下,5.6g N2和CO混合物中所含有的原子总数为0.4NA |
| B、0.1mol Na2O2中所含的阴离子数为0.2NA |
| C、将0.2mol FeCl3水解制成胶体,所得胶体粒子数为0.2NA |
| D、标准状况下,2.24L H2O中含有的氧原子数目为0.1NA |