题目内容
用NA表示阿伏加德罗常数,下列叙述中,正确的是( )
| A、常温常压下,5.6g N2和CO混合物中所含有的原子总数为0.4NA |
| B、0.1mol Na2O2中所含的阴离子数为0.2NA |
| C、将0.2mol FeCl3水解制成胶体,所得胶体粒子数为0.2NA |
| D、标准状况下,2.24L H2O中含有的氧原子数目为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氮气和一氧化碳的摩尔质量都是28g/mol,且都是双原子分子,5.6g二者的混合物中含有0.2mol分子,含有0.4mol原子;
B.过氧化钠中的阴离子为过氧根离子,0.1mol过氧化钠中含有0.1mol阴离子;
C.氢氧化铁胶体粒子是氢氧化铁的聚集体,无法计算生成胶粒的数目;
D.标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量.
B.过氧化钠中的阴离子为过氧根离子,0.1mol过氧化钠中含有0.1mol阴离子;
C.氢氧化铁胶体粒子是氢氧化铁的聚集体,无法计算生成胶粒的数目;
D.标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量.
解答:
解:A.5.6g一氧化碳和氮气的混合物中含有0.2mol分子,0.2mol氮气和一氧化碳的混合物中含有0.4mol原子,含有的原子总数为0.4NA,故A正确;
B.0.1mol Na2O2中含有0.1mol阴离子过氧根离子,所含的阴离子数为0.1NA,故B错误;
C.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算氢氧化铁胶粒的物质的量及数目,故C错误;
D.标况下水不是气体,不能使用标况下的气体摩尔体积计算2.24L水的物质的量及含有的氧原子数目,故D错误;
故选A.
B.0.1mol Na2O2中含有0.1mol阴离子过氧根离子,所含的阴离子数为0.1NA,故B错误;
C.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算氢氧化铁胶粒的物质的量及数目,故C错误;
D.标况下水不是气体,不能使用标况下的气体摩尔体积计算2.24L水的物质的量及含有的氧原子数目,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下水不是气体、氢氧化铁胶粒是氢氧化铁的聚集体,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
A、若完全燃烧,1mol雄酮(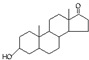 )比雌酮( )比雌酮( )多消耗3mol O2 )多消耗3mol O2 |
| B、正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 |
| C、蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应 |
| D、乙醇依次通过消去、取代、加成反应可生成乙二醇 |
 如图某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用硫酸钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔知滤纸上写“嫦娥奔月”,会出现红色字迹,据此下列叙述正确的是( )
如图某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用硫酸钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔知滤纸上写“嫦娥奔月”,会出现红色字迹,据此下列叙述正确的是( )| A、铅笔端作阴极,铂片端发生还原反应 |
| B、铅笔端有少量钠生成 |
| C、硫酸钠溶液不可用硝酸钾溶液代替 |
| D、铂片端发生的电极反应为:40H--4e-=2H2O+O2↑ |
室温下,下列混合溶液中,各离子浓度的关系正确的是( )
| A、浓度均为0.1mol?L1的醋酸溶液与氢氧化钠溶液等体积混合C(Na+)=c(CH3COO)>c(OH-)=c(H+) |
| B、浓度均为0.1mol?L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合C(SO42-)>C(Na+)>C(NH4+)>C(H+)>C(OH-) |
| C、浓度均为0.1mol?L1的小苏打溶液与烧碱溶液等体积混合C(Na+)+C(H+)=2C(CO32-)+C(OH-) |
| D、pH=12的氨水溶液与pH=2的盐酸溶液等体积混合C(NH4+)>C(Cl-)>C(OH-)>C(H+) |
分子式为C5H10O2的酸和分子式为C5H12O的醇在酸性条件下形成的酯共有( )
| A、16种 | B、20种 |
| C、32种 | D、40种 |
足量的下列物质与等体积等浓度的氢氧化钠溶液在一定条件下充分反应,消耗物质的物质的量最多的是( )
| A、S | B、Cl2 |
| C、Si | D、Al |


