题目内容
在反应式X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6g X与Y完全反应后,生成4.4g R,则参加反应的Y的质量是 .
考点:摩尔质量,质量守恒定律
专题:计算题
分析:根据化学方程式和已知条件“R和M的摩尔质量之比为22:9”以及R的质量,列出比例式,即可求出M的质量;
根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.则生成的Y的质量=R的质量+M的质量-X的质量.
根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.则生成的Y的质量=R的质量+M的质量-X的质量.
解答:
解:根据已知条件“R和M的相对分子质量之比为22:9”,则R:2M=22:2×9=22:18,
设生成的M的质量为x,
∴22:18=4.4g:x,
解之得:x=3.6g;
根据质量守恒定律可得Y的质量=4.4g+3.6g-1.6g=6.4g,
故答案为:6.4g.
设生成的M的质量为x,
∴22:18=4.4g:x,
解之得:x=3.6g;
根据质量守恒定律可得Y的质量=4.4g+3.6g-1.6g=6.4g,
故答案为:6.4g.
点评:本题主要考查学生运用化学方程式和质量守恒定律解答实际问题的能力.解题关键是根据摩尔质量之比确定R和M的质量之比.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
已知:2H2(g)+O2(g)═2H2O(l)
△H=-571.6kJ?mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)
△H=-1 452kJ?mol-1
H+(aq)+OH-(aq)═H2O(l)
△H=-57.3kJ?mol-1
下列说法正确的是( )
△H=-571.6kJ?mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)
△H=-1 452kJ?mol-1
H+(aq)+OH-(aq)═H2O(l)
△H=-57.3kJ?mol-1
下列说法正确的是( )
| A、H2(g)的燃烧热为571.6 kJ?mol-1 | ||||||
B、
| ||||||
| C、同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | ||||||
| D、3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ?mol-1 |
下列说法正确的是( )
A、若完全燃烧,1mol雄酮(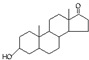 )比雌酮( )比雌酮( )多消耗3mol O2 )多消耗3mol O2 |
| B、正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 |
| C、蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应 |
| D、乙醇依次通过消去、取代、加成反应可生成乙二醇 |
化学用语是学习化学的重要工具.下列用来表示物质变化的化学用语中,错误的是( )
| A、钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- |
| B、明矾水解的离子方程式:Al3++3H2O?Al(OH)3+3H+ |
| C、足量氢氧化钠溶液与碳酸氢钠溶液混合:OH-+HCO3-═H2O+CO32- |
| D、表示氢气燃烧热的化学方程式:2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ?mol-1 |
下列说法正确的是( )
| A、将0.2mol/L某强碱弱酸盐NaA溶液与0.1mol/L盐酸等体积混合,混合后溶液显碱性,则混合溶液中 c(HA)>c(Cl-)>c(A-)>c(OH-) |
| B、相同条件下,向氨水、氢氧化钠溶液中分别加入适量的氯化铵晶体后,两溶液的pH:前者减小,后者增大 |
| C、室温条件下,将pH=3盐酸VaL与pH=11氢氧化钠溶液VbL混合,混合后溶液pH=4,假设混合后忽略体积变化,则Va:Vb=10:9 |
| D、0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
分子式为C5H10O2的酸和分子式为C5H12O的醇在酸性条件下形成的酯共有( )
| A、16种 | B、20种 |
| C、32种 | D、40种 |
 以下是一些物质的熔沸点数据(常压):
以下是一些物质的熔沸点数据(常压):