题目内容
多硫化钠Na2Sx(x>2)在结构上与Na2O2、FeS2、CaC2等有相似之处.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1:10,则x的值是( )
| A、5 | B、4 | C、3 | D、2 |
考点:氧化还原反应的计算,氧化还原反应
专题:氧化还原反应专题
分析:Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,S元素的化合价由-
价变为+6价,NaClO被还原成NaCl,Cl元素的化合价由+1价变为-1价,根据得失电子守恒计算x值.
| 2 |
| x |
解答:
解:Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,S元素的化合价由-
价变为+6价,NaClO被还原成NaCl,Cl元素的化合价由+1价变为-1价,根据得失电子守恒得,
设Na2Sx的物质的量是1mol,则次氯酸钠的物质的量是10mol,
1mol×[6-(-
)]x=10mol×[1-(-1)],
1mol×[6+
]x=10mol×2,
6x+2=20,
x=3,
故选C.
| 2 |
| x |
设Na2Sx的物质的量是1mol,则次氯酸钠的物质的量是10mol,
1mol×[6-(-
| 2 |
| x |
1mol×[6+
| 2 |
| x |
6x+2=20,
x=3,
故选C.
点评:本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意元素化合价的判断,为解答该题的关键,从元素化合价的角度解答该类题目,难度不大.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、汽车尾气中的氮氧化物与光化学烟雾形成有关 |
| B、电解氯化铝溶液可获得金属铝 |
| C、大量燃烧含硫燃料是形成酸雨的主要原因 |
| D、铜具有良好的导电性,常用来制作印刷电路板 |
室温时,下列各组离子在指定溶液中可以大量共存的是( )
| A、1.0mol/L的KNO3溶液:H+,Fe2+,K+,SO42- |
| B、由水电离出 c(H+)=1.0×10-13的溶液:Na+,CH3COO-,HCO3-,SO42- |
| C、加入甲基橙试液呈红色的溶液:NH4+,K+,SO42-,Cl- |
| D、饱和氯水中:NO3-,Na+,SO32-,Cl- |
已知:2H2(g)+O2(g)═2H2O(l)
△H=-571.6kJ?mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)
△H=-1 452kJ?mol-1
H+(aq)+OH-(aq)═H2O(l)
△H=-57.3kJ?mol-1
下列说法正确的是( )
△H=-571.6kJ?mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)
△H=-1 452kJ?mol-1
H+(aq)+OH-(aq)═H2O(l)
△H=-57.3kJ?mol-1
下列说法正确的是( )
| A、H2(g)的燃烧热为571.6 kJ?mol-1 | ||||||
B、
| ||||||
| C、同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | ||||||
| D、3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ?mol-1 |
关于下列各实验装置的叙述中,不正确的是( )

| A、装置①可用于验证Na与H2O反应是否放热 |
| B、装置②可用于比较Na2CO3与NaHCO3的稳定性 |
| C、装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| D、装置④可用于干燥、收集NH3,并吸收多余的NH3 |
四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子核质子数之比为1:2,X和Y的电子数之差为4.下列说法正确的是( )
| A、原子半径大小:Z>Y>X>W |
| B、W、Y、Z中最简单氢化物稳定性最弱的是W |
| C、Z元素单质在化学反应中只表现氧化性 |
| D、z元素氧化物对应水化物的酸性一定强于Y |
下列说法正确的是( )
A、若完全燃烧,1mol雄酮(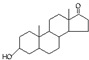 )比雌酮( )比雌酮( )多消耗3mol O2 )多消耗3mol O2 |
| B、正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 |
| C、蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应 |
| D、乙醇依次通过消去、取代、加成反应可生成乙二醇 |
 X、Y、Z是三种常见的物质,它们之间存在着如图的转化关系:
X、Y、Z是三种常见的物质,它们之间存在着如图的转化关系: