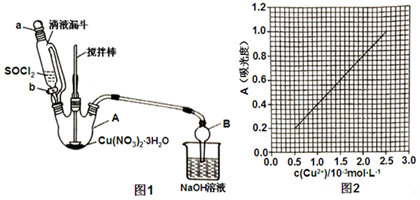
题目内容
3.氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
已知:①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②

回答下列问题:
(1)A的化学名称为丙酮.
(2)B的结构简式为
 ,
,(3)B的核磁共振氢谱显示为2组峰,峰面积比为1:6;C中所含官能团的名称为碳碳双键、氰基 (填官能团名称)
(4)由C生成D的反应类型为取代反应.
(5)由D生成E的化学方程式为
 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl.
+NaCl.(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有8种.(不含立体异构)
分析 A的相对分子质量为58,氧元素质量分数为0.276,则A分子中氧原子数目为$\frac{58×0.276}{16}$=1,分子中C、H原子总相对原子质量为58-16=42,则分子中最大碳原子数目为$\frac{42}{12}$=3…6,故A的分子式为C3H6O,其核磁共振氢谱显示为单峰,且发生信息中加成反应生成B,故A为 ,B为
,B为 ,B发生消去反应生成C为
,B发生消去反应生成C为 ,C与氯气光照反应生成D,D发生水解反应生成E,结合E的分子式可知,C与氯气发生取代反应生成D,则D为
,C与氯气光照反应生成D,D发生水解反应生成E,结合E的分子式可知,C与氯气发生取代反应生成D,则D为 ,E发生氧化反应生成F,F与甲醇发生酯化反应生成G,则E为
,E发生氧化反应生成F,F与甲醇发生酯化反应生成G,则E为 ,F为
,F为 ,G为
,G为 ,以此来解答.
,以此来解答.
解答 解:(1)由上述分析可知,A为 ,化学名称为丙酮,故答案为:丙酮;
,化学名称为丙酮,故答案为:丙酮;
(2)由 上述分析可知,B的结构简式为
上述分析可知,B的结构简式为 ,故答案为:
,故答案为: ;
;
(3)B的核磁共振氢谱显示为2组峰,峰面积比为1:6,C中所含官能团的名称为碳碳双键、氰基,故答案为:2;1:6;碳碳双键、氰基;
(4)由C生成D的反应类型为取代反应,故答案为:取代反应;
(5)由D生成E的化学方程式为 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl,
+NaCl,
故答案为: +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl;
+NaCl;
(6)G( )的同分异构体中,与G具有相同官能团且能发生银镜反应,含有甲酸形成的酯基:HCOOCH2CH=CH2、HCOOCH=CHCH3、HCOOC(CH3)=CH2,当为HCOOCH2CH=CH2时,-CN的取代位置有3种,当为HCOOCH=CHCH3时,-CN的取代位置有3种,当为HCOOC(CH3)=CH2时,-CN的取代位置有2种,共有8种,
)的同分异构体中,与G具有相同官能团且能发生银镜反应,含有甲酸形成的酯基:HCOOCH2CH=CH2、HCOOCH=CHCH3、HCOOC(CH3)=CH2,当为HCOOCH2CH=CH2时,-CN的取代位置有3种,当为HCOOCH=CHCH3时,-CN的取代位置有3种,当为HCOOC(CH3)=CH2时,-CN的取代位置有2种,共有8种,
故答案为:8.
点评 本题考查有机物的合成,为高频考点,把握合成流程中碳链变化、官能团变化、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用及习题中的信息,题目难度不大.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | a点反应的离子方程式为 IO3-+3HSO3-=I-+3SO42-+3H+ | |
| B. | b点到c点反应的离子方程式为 IO3-+5I-+6H+=3I2+3H2O | |
| C. | 当溶液中的I-为0.4 mol时,加入的KIO3只能为0.4 mol | |
| D. | 若往100 mL 1mol/L的KIO3溶液中逐滴滴加NaHSO3溶液,反应开始时的离子方程式为 2IO3-+5HSO3-=I2+5SO42-+H2O+3H+ |
| A. | CuSO4+H2S═CuS↓+H2SO4 | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2FeCl3+Cu═2FeCl2+CuCl2 | D. | Cu2(OH)2CO3═2CuO+CO2↑+H2O |
| A. | 氯气的电子式:Cl:Cl | B. | 硫原子的结构示意图: | ||
| C. | 溴化钠的电子式: | D. | 质量数为37的氯原子 ${\;}_{17}^{37}$Cl |
| A. | CO2 | B. | Fe2O3 | C. | Al(OH)3 | D. | CuO |