题目内容
17.将m molNa2O2和n molNaHCO3固混合物在密闭容器中加热到250℃,让其充分反应后排出气体,当排出气体只含H2O(g)和O2且物质的量相等时,则原固体混合物中m:n=1:1.分析 设出H2O(g)和O2的物质的量,根据关系式2Na2O2~O2、2NaHCO3~H2O计算过氧化钠和碳酸氢钠的物质的量即可.
解答 解:排出气体只含H2O(g)和O2且物质的量相等,设H2O(g)和O2的物质的量都是xmol,
根据关系式2Na2O2~O2可知,原混合物中Na2O2的物质的量为2xmol,
根据H元素守恒可知NaHCO3的物质的量为:n(NaHCO3)=2n(H2O)=2xmol,
原固体混合物中m:n=2xmol:2xmol=1:1,
故答案为:1:1.
点评 本题考查化学方程式的计算,题目难度不大,明确发生的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
7.茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案测定某品牌茶叶中钙元素的质量分数,并检验铁元素的存在(已知CaC2O4为白色沉淀物质).首先取200g茶叶样品焙烧得灰粉后进行如图操作:
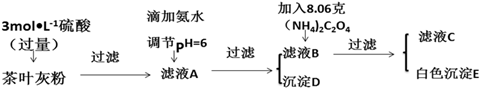
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
实验前要先将茶叶样品高温灼烧成灰粉,其主要目的使样品中的有机物完全分解,将钙、铁等微量元素转化为可溶性物质.
(2)写出从滤液A→沉淀D的离子反应方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,判断D已经沉淀完全方法是静置,向上层清液中继续滴加氨水若无红褐色沉淀生成则说明D已沉淀完全,否则未沉淀完全.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.

①此步操作过程中KMnO4标准溶液应装在图2中哪个仪器中(填写字母)B.
②滴定到终点,现象无色变为浅红色,静置后,如图3方法读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高(填“偏高”“偏低”或“无影响”).
(5)原茶叶中钙元素的质量分数为0.3%.

请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |
(2)写出从滤液A→沉淀D的离子反应方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,判断D已经沉淀完全方法是静置,向上层清液中继续滴加氨水若无红褐色沉淀生成则说明D已沉淀完全,否则未沉淀完全.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.

①此步操作过程中KMnO4标准溶液应装在图2中哪个仪器中(填写字母)B.
②滴定到终点,现象无色变为浅红色,静置后,如图3方法读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高(填“偏高”“偏低”或“无影响”).
(5)原茶叶中钙元素的质量分数为0.3%.
8.常温下,在pH=1的某溶液中可能有Na+、Fe2+、Fe3+、I-、Cl-、CO32-中的几种,现取100mL,该溶液进行如下实验,根据实验结果,下列判断正确的是( )


| A. | Fe2+、I-、Cl-三种离子一定存在 | |
| B. | CO32-一定不存在,不能确定Na+和Cl-是否存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)至少为0.2mol•L-1 |
5.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 100g质量分数为98%的浓硫酸中所含有的氧原子数为4NA | |
| B. | 足量的Fe与6.72LCl2反应转移的电子数为0.6NA | |
| C. | 密闭容器中1molN2与4molH2反应生成的NH3分子数小于2NA | |
| D. | 3g乙烷含有共用电子对为0.6NA |
12.为证明氨水是弱电解质,下列方法不正确的是( )
| A. | 在0.1mol•L-1氨水中加几滴酚酞,再加等体积的醋酸铵溶液,观察红色是否变浅 | |
| B. | 测定0.1 mol•L-1NH4C1溶液的酸碱性 | |
| C. | 测定0.lmol•L-1氨水的pH | |
| D. | 比较浓度均为0.1 mol•L -1的氨水与NaOH溶液的导电能力 |
20.下列关于有机物的叙述不正确的是( )
| A. | 甲烷、甲苯、乙醇、乙酸都可以发生取代反应 | |
| B. | 可用浓溴水来区分乙醇和苯酚 | |
| C. | 乙酸乙酯在无机酸或碱存在时都能发生水解反应 | |
| D. | 能发生水解反应的有机物只有卤代烃和酯类 |
1.下列说法中正确的是( )
| A. | 将纯水加热的过程中,KW变大,酸性增强 | |
| B. | 保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解 | |
| C. | NaHCO3溶液蒸干、灼烧至恒重,最终得到NaHCO3固体 | |
| D. | 相同浓度的下列溶液中:①CH3COONH4、②CH3COONa、③CH3COOH中,c(CH3COCO-)由大到小的顺序是②>①>③ |
 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

 ,
, +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl.
+NaCl.