题目内容
19.某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2•3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2.设计的合成路线如下:Cu屑(含Fe)$→_{①}^{足量HNO_{3}}$ $→_{②}^{调pH}$ Cu(NH3)2溶液$\stackrel{③}{→}$Cu(NH3)2•3H2O晶体$→_{④}^{SOCl}$无水Cu(NH3)
已知:Cu(NO3)2•3H2O$\stackrel{170℃}{→}$Cu(NO3)2•Cu(OH)2$\stackrel{200℃}{→}$CuO,SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体.
请回答:(1)第②步调pH适合的物质是CuO或Cu(OH)2或Cu2(OH)2CO3(填化学式)
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是将溶液转移至蒸发皿中,控制温度(不高于170℃),加热至溶液表面形成一层晶膜.为得到较大颗粒的Cu(NO3)2•3H2O晶体,可采用的方是形成一层晶膜减慢冷却结晶的速度(填一种)
(3)第④步中发生反应的化学方程式是Cu(NO3)2•3H2O+3SOC12=Cu(NO3)2+3SO2↑+6HCI↑.
(4)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图1)有一处不合理,请提出改进方案并说明理由在AB之间增加干燥装置,防止B中的水蒸气进入A中装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞b(填“a”、“b”或“a和b”)
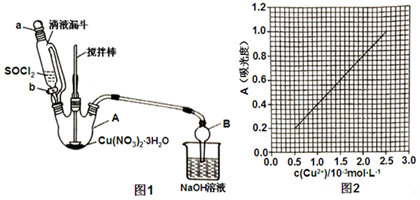
(5)为测定无水Cu(NO3)2产品的纯度,可用分光光度法.
已知:4NH3•H2O+Cu2+=Cu(NH3)42++4H2O;Cu(NH3)42+对特定波长光的吸收程度(用吸光度A表示)与Cu2+在一定浓度范围内成正比.现测得Cu(NH3)42+的吸光度A与Cu2+标准溶液浓度关系如图2所示:准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3•H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是95.5%(以质量分数表示).
分析 含铁的铜屑用过量的硝酸溶解,得到的溶液为Cu(NO3)2、Fe(NO3)3的酸性溶液,条件pH沉淀铁离子,得到Cu(NO3)2溶液,蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到Cu(NO3)2•3H2O晶体,与SOCl2制混合得到用无水Cu(NO3)2;
(1)调节pH促进铁离子水解沉淀铁离子,不引入新杂质,同时不能沉淀铜离子,据此分析;
(2)根据题意,温度不能高于170℃,否则Cu(NO3)2•3H2O变质,出现晶膜后减慢结晶速度可得到较大颗粒的晶体;
(3)Cu(NO3)2•3H2O和SOC12发生反应生成硝酸铜、二氧化硫气体和氯化氢气体;
(4)A、B间缺少干燥装置;向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b;
(5)由图可知,溶液吸光度A=0.600时,Cu2+标准溶液浓度为1.5×10-3mol/L,据此计算.
解答 解:(1)调节pH促进铁离子水解沉淀铁离子,不引入新杂质,同时不能沉淀铜离子,可选用CuO或Cu(OH)2或Cu2(OH)2CO3;
故答案为:CuO或Cu(OH)2或Cu2(OH)2CO3;
(2)根据题意,温度不能高于170℃,否则Cu(NO3)2•3H2O变质,故蒸发浓缩应将溶液转移至蒸发皿中,控制温度(不高于170℃),加热至溶液表面形成一层晶膜减慢冷却结晶的速度,可得到较大颗粒的Cu(NO3)2•3H2O晶体;
故答案为:将溶液转移至蒸发皿中,控制温度(不高于170℃),加热至溶液表面形成一层晶膜;形成一层晶膜减慢冷却结晶的速度;
(3)第④步中发生的反应为Cu(NO3)2•3H2O和SOC12发生反应生成硝酸铜、二氧化硫气体和氯化氢气体,化学方程式为:Cu(NO3)2•3H2O+3SOC12=Cu(NO3)2+3SO2↑+6HCI↑;
故答案为:Cu(NO3)2•3H2O+3SOC12=Cu(NO3)2+3SO2↑+6HCI↑;
(4)为防止B中的水蒸气进入A中,故在AB之间增加干燥装置;向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b;
故答案为:在AB之间增加干燥装置,防止B中的水蒸气进入A中;b;
(5)由图可知,溶液吸光度A=0.620时,Cu2+标准溶液浓度为1.6×10-3mol/L,则样品中Cu(NO3)2的质量为1.6×10-3mol/L×$\frac{100mL}{10mL}$×188g/mol=0.3008g,则无水Cu(NO3)2产品的纯度是$\frac{0.3008g}{0.3150}$×100%=95.5%;
故答案为:95.5%.
点评 本题考查了物质的制备,涉及了元素的相关性质,实验设计,操作控制,方程式的书写、纯度的计算等,要求学生对物质基本性质的掌握,并加以灵活运用,题目难度中等.

| A. | 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高 | |
| B. | 向盛有5mL 4%和5mL 12%的过氧化氢溶液中分别加入几滴等浓度的氯化铁溶液,后者产生气泡速率快 | |
| C. | KI溶液中加少量新制的氯水,再加少量苯充分振荡后静置,上层为紫红色 | |
| D. | 用pH试纸测溶液的pH和用红色石蕊试纸检测气体时均不需要润湿 |
| A. | NaCl | B. | MgCl2 | C. | NaHCO3 | D. | H2CO3 |
请回答下列有关问题:
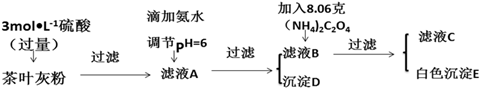
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |
(2)写出从滤液A→沉淀D的离子反应方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,判断D已经沉淀完全方法是静置,向上层清液中继续滴加氨水若无红褐色沉淀生成则说明D已沉淀完全,否则未沉淀完全.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.

①此步操作过程中KMnO4标准溶液应装在图2中哪个仪器中(填写字母)B.
②滴定到终点,现象无色变为浅红色,静置后,如图3方法读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高(填“偏高”“偏低”或“无影响”).
(5)原茶叶中钙元素的质量分数为0.3%.
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
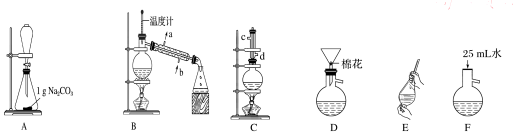
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是冷却后补加.
(2)B装置的冷凝管的主要作用是冷凝收集产品,可否换为球形冷凝管否(填“可”或“否”).
(3)制备和提纯苯甲酸甲酯的操作先后顺序为CFEADB(填装置字母代号).
(4)A中Na2CO3的作用是除去苯甲酸甲酯中的苯甲酸;D装置的作用是除去没有反应完的Na2CO3
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后b(填标号).
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出.

| A. | Fe2+、I-、Cl-三种离子一定存在 | |
| B. | CO32-一定不存在,不能确定Na+和Cl-是否存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)至少为0.2mol•L-1 |

 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

 ,
, +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl.
+NaCl.