题目内容
15.草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到有二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO;
假设二:全部是Fe3O4;
假设三:是FeO和Fe3O4的混合物.
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成下面的内容:
实验步骤(不要求写出具体操作过程)预期实验现象和结论取少量黑色固体,加入适量稀盐酸或稀硫酸,在溶液中加入硫氰化钾溶液,溶液不变红色,则假设一成立,溶液变成红色,则假设一不成立
【定量研究】课题组在文献中查阅到,FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线 如图所示:

写出加热到400℃时,FeC2O4.2H2O晶体受热分解的化学方程式为:FeC2O4•2H2O═FeO+CO2↑+CO↑+2H2O↑.
分析 (1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量;
(2)草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体可能为氧化亚铁或四氧化三铁,分析判断;
(3)【定性研究】氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
【定量研究】根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式.
解答 解:(1)盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到有二氧化碳气体生成,草酸亚铁被氧化为铁离子和二氧化碳,说明草酸亚铁具有还原性;根据氧化还原反应得失电子数相等、原子守恒、电荷守恒可写出化学方程式,化学方程式为5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++10 CO2↑+3Mn2++12H2O,反应中消耗1 mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol,
故答案为:还原性;0.6;
(2)草酸亚铁加热分解生成几种氧化物,残留物为黑色固体,故可能为FeO和Fe3O4中的一种或几种,故假设二为Fe3O4,假设三为FeO和Fe3O4,
故答案为:全部是Fe3O4;是FeO和Fe3O4的混合物;
(3)【定性研究】为了验证假设一成不成立,由于假设一为只有氧化亚铁,所以只需要检验残余固体中是否含有三价铁离子即可,操作为取少量黑色固体,加适量盐酸或稀硫酸溶解后,再向溶液中加几滴KSCN溶液,看是否出现血红色,如果不出现血红色则假设一成立,出现血红色则假设一不成立,
故答案为:加入适量稀盐酸或稀硫酸,在溶液中加入硫氰化钾溶液,溶液不变红色,则假设一成立,溶液变成红色,则假设一不成立;
【定量研究】从图象上可以看出加热分解的FeC2O4•2H2O的质量为1g,从开始到A点样品的质量变为0.8g,减少了0.2g,又经计算草酸晶体中水的质量分数为20%,可得到该温度范围内发生的反应是:草酸亚铁晶体加热失去结晶水,A点的温度为300℃;从A到B质量从0.8g降低到0.4g,根据(2)中的猜想和计算可得:1g草酸亚铁晶体分解生成的物质如果为氧化亚铁的话,刚好能够得到0.4g氧化亚铁;从B到C剩余固体的质量又呈现增大的趋势,此时应该是400℃以前得到的氧化亚铁被氧化为四氧化三铁了;经上述分析,400℃时一定反应生成氧化亚铁和二氧化碳,铁元素化合价未发生变化,碳的化合价升高,发生了氧化反应,氧化反应和还原反应应该是同时发生的,所以碳一定还有化合价降低生成+2价的CO,反应的化学返程式为:FeC2O4•2H2O═FeO+CO2↑+CO↑+2H2O↑,
故答案为:FeC2O4•2H2O═FeO+CO2↑+CO↑+2H2O↑.
点评 本题考查了探究物质组成与含量的方法,题目难度中等,明确实验目的、实验原理为解答关键,试题知识点较多、综合性较强,试题侧重考查学生的分析、理解能力及化学实验能力.

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案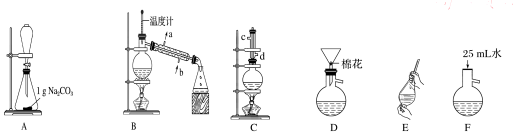
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是冷却后补加.
(2)B装置的冷凝管的主要作用是冷凝收集产品,可否换为球形冷凝管否(填“可”或“否”).
(3)制备和提纯苯甲酸甲酯的操作先后顺序为CFEADB(填装置字母代号).
(4)A中Na2CO3的作用是除去苯甲酸甲酯中的苯甲酸;D装置的作用是除去没有反应完的Na2CO3
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后b(填标号).
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出.
| A. | 在0.1mol•L-1氨水中加几滴酚酞,再加等体积的醋酸铵溶液,观察红色是否变浅 | |
| B. | 测定0.1 mol•L-1NH4C1溶液的酸碱性 | |
| C. | 测定0.lmol•L-1氨水的pH | |
| D. | 比较浓度均为0.1 mol•L -1的氨水与NaOH溶液的导电能力 |
| A. | 甲烷、甲苯、乙醇、乙酸都可以发生取代反应 | |
| B. | 可用浓溴水来区分乙醇和苯酚 | |
| C. | 乙酸乙酯在无机酸或碱存在时都能发生水解反应 | |
| D. | 能发生水解反应的有机物只有卤代烃和酯类 |
| A. | OH-、K+、Cl- | B. | Ca2+、NO3-、CO32- | C. | Fe3+、Na+、OH- | D. | H+、HCO3-、SO42- |
 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | X单质与Z单质与食盐溶液中构成原电池,Z的单质被氧化 | |
| B. | Y、W的最简单氢化物的水溶液能相互反应 | |
| C. | X、W可形成离子化合物XW | |
| D. | W形成含氧酸为强酸 |
| A. | 二甲醚(CH3OCH3)和乙醇 | |
| B. | CH3CH2COOH和CH3COOCH3 | |
| C. |  | |
| D. | 正己烷和环己烷 |
 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

 ,
, +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl.
+NaCl. .
. .1molA转化成异丁烷消耗氢气的体积为22.4L(标准状况).
.1molA转化成异丁烷消耗氢气的体积为22.4L(标准状况).
 .
.