题目内容
13.现有1L的 Al2(SO4)3溶液,含Al3+216g,取250mL溶液稀释到4L,则稀释后溶液中SO42-的物质的量浓度是0.75mol/L.分析 根据n=$\frac{m}{M}$计算mg Al3+的物质的量,进而计算250mL溶液中Al3+的物质的量,根据电荷守恒可知2n(SO42-)=3n(Al3+),据此计算250mL溶液中SO42-的物质的量,稀释为4VmL,溶液中SO42-的物质的量不变,再根据c=$\frac{n}{V}$计算稀释后溶液SO42-的物质的量浓度.
解答 解:216gAl3+的物质的量为$\frac{216g}{27g/mol}$=8mol,故250mL溶液中Al3+的物质的量为8mol×$\frac{0.25L}{1L}$=2mol,根据电荷守恒可知2n(SO42-)=3n(Al3+),故250mL溶液中SO42-的物质的量为2mol×$\frac{3}{2}$=3mol,取250mL溶液稀释到4L,则稀释后溶液SO42-的物质的量浓度为$\frac{3mol}{4L}$=0.75mol/L;
故答案为:0.75mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意掌溶质与其含有离子浓度之间转化关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
9.将相同状况下的下列气体分别充满一干燥烧瓶中,把烧瓶倒置于水中,瓶内液面逐渐上升,假设烧瓶内溶液不扩散,则最终该溶液中溶质的物质的量浓度大小关系为( )
①NH3;②NO2;③体积比4:1混合的NO2和O2;④NO(用导管向烧瓶中缓缓通入O2至气体恰好完全吸收)
①NH3;②NO2;③体积比4:1混合的NO2和O2;④NO(用导管向烧瓶中缓缓通入O2至气体恰好完全吸收)
| A. | ①=②>③>④ | B. | ①=②=③=④ | C. | ①=②=④>③ | D. | ①>③>②>④ |
4.食品卫生与健康密切相关,下列做法会导致食品对人体有害的是( )
①有些食品加工厂将塑化剂添加到食品中 ②石灰水保存鲜鸡蛋
③为了使火腿肠颜色更鲜红,可以多加一些亚硝酸钠④蒸馒头时加入适量纯碱.
①有些食品加工厂将塑化剂添加到食品中 ②石灰水保存鲜鸡蛋
③为了使火腿肠颜色更鲜红,可以多加一些亚硝酸钠④蒸馒头时加入适量纯碱.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
1.质量分数不同的两种硫酸溶液,以相同质量混合时,所得混合溶液的密度为ρ1;以相同体积混合时,所得混合溶液的密度为ρ2,两种浓度不同的乙醇(密度小于水)溶液,以相同质量混合时,所得混合溶液的密度为ρ3;以相同体积混合时,所得溶液密度为ρ4,则ρ1、ρ2、ρ3、ρ4大小之间关系为( )
| A. | ρ1>ρ2>ρ3>ρ4 | B. | ρ1>ρ2>ρ4>ρ3 | C. | ρ2>ρ1>ρ3>ρ4 | D. | ρ2>ρ1>ρ4>ρ3 |
18.在一定条件下,对于密闭容器中进行的可逆反应:2HI(g) $\stackrel{△}{?}$H2(g)+I2(g),下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )
| A. | HI、H2、I2的浓度相等 | B. | HI、H2、I2的浓度不再发生变化 | ||
| C. | HI、H2、I2在密闭容器中共存 | D. | 容器内气体的颜色不再发生变化 |
5.有如图所示装置,下列有关说法正确的是( )
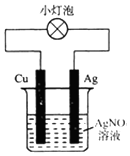

| A. | 该装置外电路中电流由Cu棒转移到Ag棒 | |
| B. | 该装置中正极是Cu、负极是Ag | |
| C. | 该装置可以将电能转化为化学能 | |
| D. | 该装置中正极上的电极反应为Ag++e-=Ag |
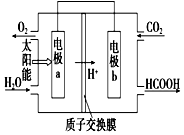 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.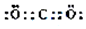 ,
,