题目内容
3.(1)现有下列状态的物质①干冰 ②NaCl晶体 ③氨水 ④铜 ⑤熔融的KOH,其中属于电解质的是②⑤(填序号),属于非电解质的是①(填序号),能导电的是③④⑤(填序号).(2)某有色电解质溶液中,可能大量存在有Ag+、H+、Cu2+、OH-、Cl-离子,你认为:一定没有的离子是Ag+、OH-,不能确定的离子H+.
分析 (1)在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,含有自由移动电子或离子的物质能导电;
(2)有色电解质溶液中,一定含Cu2+,则一定没有OH-,由溶液为电中性可知,阴离子一定为Cl-,则没有Ag+,以此来解答.
解答 解:(1)②⑤在水溶液里或熔融状态下能电离出阴阳离子而使其水溶液或熔融状态导电,所以属于电解质;
①的水溶液能电离出阴阳离子的是碳酸,所以二氧化碳是非电解质,
③⑤含有自由移动的离子,④中含有自由移动的电子,所以能导电;
③氨水是混合物,④铜是单质,所以氨水和铜既不是电解质也不是非电解质.
故答案为:②⑤;①;③④⑤;
(2)有色电解质溶液中,一定含Cu2+,则一定没有OH-,由溶液为电中性可知,阴离子一定为Cl-,则没有Ag+,综上所述,一定含Cu2+、Cl-,一定不含Ag+、OH-,可能含H+,
故答案为:Ag+、OH-;H+.
点评 本题考查了电解质、非电解质的概念及导电性、离子的推断等知识,为高频考点,侧重考查学生的分析能力和实验能力,较基础,注意离子推断中离子的共存及电中性原则.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
8.下列关于有机物的说法正确的是( )
| A. | C5H11Br有7 种同分异构体 | |
| B. | 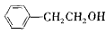 能发生取代、加成、氧化、消去等反应 能发生取代、加成、氧化、消去等反应 | |
| C. | 合成纤维和光导纤维都是新型无机非金属材料 | |
| D. | 溴丙烷水解制丙醇和丙烯与水反应制丙醇的反应类型相同 |
14.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 3g ${\;}_{1}^{3}$H发生核反应:${\;}_{1}^{2}H$+${\;}_{1}^{3}H$→${\;}_{2}^{4}He$+${\;}_{0}^{1}n$,净产生的中子数为NA | |
| B. | 0.1L1mol/L盐酸含有的H+的数目为0.1NA | |
| C. | 标准状况下,22.4LCCl4含有的原子数目为5 NA | |
| D. | 1L0.4mol/L浓盐酸与足量的MnO2反应转移电子的物质的量为0.2 NA |
11.将质量分数为35%的氨水与质量分数为5%的氨水等体积混合后,所得氨水的质量分数为( )
| A. | 等于20% | B. | 大于20% | C. | 小于20% | D. | 无法计算 |
15. (1)已知25℃和101kPa时
(1)已知25℃和101kPa时
①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-a kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-b kJ/mol
③C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H3=-c kJ/mol
试计算2CO(g)+4H2(g)═H2O(l)+C2H5OH(l)的△H=-(2a+4b-c)kJ/mol.
(2)对反应N2O4(g)?2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法 不正确的是BC.
A.A、C两点的反应速率:A<C
B.B、C两点的气体的平均相对分子质量:B>C
C.A、C两点气体的颜色:A深,C浅
D.由状态A到状态B,可以用降温的方法
(3)在100℃时,将0.50mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
①上述条件下,前20秒二氧化氮的平均反应速率为0.0025mol/(L•s),平衡时二氧化氮的转化率为40%.
②该温度下,反应的平衡常数K值为2.2.(保留一位小数)
(4)甲醇-空气的燃料电池(电解质为KOH溶液)得到广泛应用,请写出该燃料电池负极的电极反应式CH3OH+8OH--6e-=CO32-+6H2O,若通入空气之前电解质KOH溶液的浓度为0.6mol/L,体积为100mL,当电子转移0.15mol后电解质溶液的pH为13.(体积保持不变,室温条件)
(5)电离度指弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数的百分数.若室温下,c mol/L氨水的电离平衡常数为Kb,则该氨水的电离度 α=$\sqrt{\frac{{K}_{b}}{c}}$.(请用c和Kb表示,可进行近似计算)
 (1)已知25℃和101kPa时
(1)已知25℃和101kPa时①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-a kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-b kJ/mol
③C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H3=-c kJ/mol
试计算2CO(g)+4H2(g)═H2O(l)+C2H5OH(l)的△H=-(2a+4b-c)kJ/mol.
(2)对反应N2O4(g)?2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法 不正确的是BC.
A.A、C两点的反应速率:A<C
B.B、C两点的气体的平均相对分子质量:B>C
C.A、C两点气体的颜色:A深,C浅
D.由状态A到状态B,可以用降温的方法
(3)在100℃时,将0.50mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.50 | n1 | 0.34 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.10 | 0.10 |
②该温度下,反应的平衡常数K值为2.2.(保留一位小数)
(4)甲醇-空气的燃料电池(电解质为KOH溶液)得到广泛应用,请写出该燃料电池负极的电极反应式CH3OH+8OH--6e-=CO32-+6H2O,若通入空气之前电解质KOH溶液的浓度为0.6mol/L,体积为100mL,当电子转移0.15mol后电解质溶液的pH为13.(体积保持不变,室温条件)
(5)电离度指弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数的百分数.若室温下,c mol/L氨水的电离平衡常数为Kb,则该氨水的电离度 α=$\sqrt{\frac{{K}_{b}}{c}}$.(请用c和Kb表示,可进行近似计算)