题目内容
某有机化合物仅由碳、氢、氧三种元素组成,经测定其相对分子质量为90.称取该有机物样品1.8g,在足量纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g.
(1)通过计算得出该有机化合物的分子式为 (简要写出计算过程 )
(2)经过红外光谱分析得知该分子中存在C=O C-O C-H 等化学键,且核磁共振氢谱中只有一组峰,该有机物的结构简式为 .
(1)通过计算得出该有机化合物的分子式为
(2)经过红外光谱分析得知该分子中存在C=O C-O C-H 等化学键,且核磁共振氢谱中只有一组峰,该有机物的结构简式为
考点:有关有机物分子式确定的计算
专题:
分析:(1)根据有机物的质量和相对分子质量可计算有机物的物质的量,根据生成的水和二氧化碳的质量可计算有机物中含有的C、H原子个数,结合相对分子质量可计算O原子个数,进而可求得分子式;
(2)结合红外光谱分析得知该分子中存在C=O、C-O、C-H等化学键,且核磁共振氢谱中只有一组峰,说明只有一种等效氢,确定其结构简式.
(2)结合红外光谱分析得知该分子中存在C=O、C-O、C-H等化学键,且核磁共振氢谱中只有一组峰,说明只有一种等效氢,确定其结构简式.
解答:
解::(1)设有机物的分子式为CXHYOz,
n(CXHYOz)=
=0.02mol,
n(H2O)=
=0.06mol,
n(CO2)=
=0.06mol,
所以x=3,y=6.
又因为有机物分子量为90,则有机物中O原子数为
=3,z=3,
故推得有机物分子式为C3H6O3,
故答案为:C3H6O3;
(2)红外光谱分析得知该分子中存在C=O、C-O、C-H等化学键,且核磁共振氢谱中只有一组峰,说明只有一种等效氢,因此该有机物的结构简式为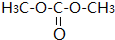 ,
,
故答案为: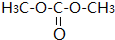 .
.
n(CXHYOz)=
| 1.8g |
| 90g/mol |
n(H2O)=
| 1.08g |
| 18g/mol |
n(CO2)=
| 2.64g |
| 44g/mol |
所以x=3,y=6.
又因为有机物分子量为90,则有机物中O原子数为
| 90-12×3-1×6 |
| 16 |
故推得有机物分子式为C3H6O3,
故答案为:C3H6O3;
(2)红外光谱分析得知该分子中存在C=O、C-O、C-H等化学键,且核磁共振氢谱中只有一组峰,说明只有一种等效氢,因此该有机物的结构简式为
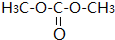 ,
,故答案为:
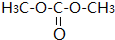 .
.
点评:本题考查有机物分子式的确定,侧重于学生分析能力和计算能力的考查,题目难度中等,注意根据相对分子质量确定氧原子个数.

练习册系列答案
相关题目
已知氧化性Fe3+>Cu2+,向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
| A、溶液中一定含有Fe2+ |
| B、溶液中一定含Cu2+ |
| C、剩余固体中一定含铜 |
| D、加入KSCN溶液一定不变红色 |
保护地下钢管不受腐蚀,可使它连接( )
| A、铜板 | B、石墨 |
| C、直流电源负极 | D、直流电源正极 |
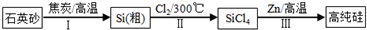
 ).
).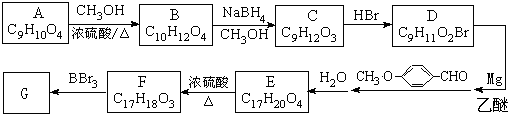
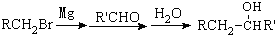
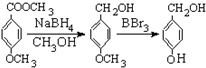
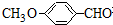 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式: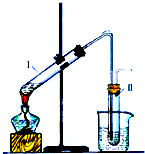 如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题:
如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题: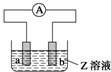 如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,
如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,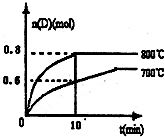 (1)已知:N2(g)+O2(g)=2NO(g)△H=180.5kJ?mol-1
(1)已知:N2(g)+O2(g)=2NO(g)△H=180.5kJ?mol-1