题目内容
1.下列说法正确的是( )| A. | 在101 k Pa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热 量,则C的燃烧热为110.5 kJ/mol | |
| B. | 在10l k Pa时l mol H2完全燃烧生成液态水放出285.8 kJ热量,H2燃烧热为-285.8kJ/mol | |
| C. | 鉴定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |
分析 A、燃烧热是C燃烧生成CO2时放出的热量;
B、燃烧热为正值;
C、测定中和热的方法是利用量热计测定开始和反应终止时的温度计算得到;
D、浓硫酸溶解放热.
解答 解:A、C的燃烧热是C完全燃烧生成CO2时放出的热量,故A错误;
B、1mol氢气燃烧生成液态水放出的热量是氢气的燃烧热,则H2的燃烧热为:285.8kJ•mol-1,故B错误;
C、中和热测定需要酸和碱溶液温度相同,利用测定开始和反应终了温度,依据Q=-C(T2-T1)计算反应的反应热,需要测定3个温度,故C正确;
D、浓硫酸溶解时放热,0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ,故D错误.
故选:C.
点评 本题考查了燃烧热、中和热概念的分析应用,中和热的测定方法,题目难度不大,侧重于基础知识的考查,注意浓硫酸溶解放热.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
12.下列关于铁的叙述错误的是( )
| A. | 纯净的铁是光亮的银白色金属 | |
| B. | 铁能被磁铁吸引,在磁场作用下,铁自身也能产生磁性 | |
| C. | 铁是地壳中含量最多的金属元素,所以分布在地壳的铁有游离态也有化合态 | |
| D. | 纯铁的抗蚀能力相当强,在干燥的空气里不易被氧化 |
9.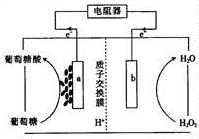 酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )
酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )
 酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )
酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )| A. | 该电池可以在高温条件下使用 | |
| B. | H+通过交换膜从b极区移向a极区 | |
| C. | 电极a是正极 | |
| D. | 电池负极的电极反应式为C6H1206+H20-2e一═C6H1207+2H+ |
16.下列有关NaHCO3与Na2CO3的说法中,正确的是( )
| A. | 分别加热两种样品,没有残留物质是NaHCO3 | |
| B. | 分别配成溶液,再加入石灰水,无白色沉淀生成的是NaHCO3 | |
| C. | 分别配成溶液,向其中逐滴加入同浓度的盐酸反应,先产生CO2的是NaHCO3 | |
| D. | 二者在一定条件下不能相互转化 |
6.下列实验误差分析错误的是( )
| A. | 用润湿的pH试纸测食盐水的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所取溶液体积偏小 | |
| D. | 中和滴定实验时,锥形瓶先用蒸馏水再用待测液润洗,所测溶液浓度偏大 |