题目内容
12.下列关于铁的叙述错误的是( )| A. | 纯净的铁是光亮的银白色金属 | |
| B. | 铁能被磁铁吸引,在磁场作用下,铁自身也能产生磁性 | |
| C. | 铁是地壳中含量最多的金属元素,所以分布在地壳的铁有游离态也有化合态 | |
| D. | 纯铁的抗蚀能力相当强,在干燥的空气里不易被氧化 |
分析 A.Fe为银白色金属;
B.铁能被磁铁吸引;
C.地壳中含量最多的金属元素为Al;
D.Fe腐蚀时与氧气、水反应.
解答 解:A.Fe具有金属通性,纯净的铁是光亮的银白色金属,故A正确;
B.铁能被磁铁吸引,则在磁场作用下,铁自身也能产生磁性,故B正确;
C.地壳中含量最多的金属元素为Al,Fe的含量仅次于Al,故C错误;
D.Fe腐蚀时与氧气、水反应,则纯铁的抗蚀能力相当强,在干燥的空气里不易被氧化,故D正确;
故选C.
点评 本题考查铁的性质,为高频考点,把握Fe的物理性质、特性及铁的腐蚀为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.将两A、B分别用导线相连接,并同时插入电解质溶液中,发现A极的质量增加,则下列说法正确的是( )
| A. | 金属活动性:A>B | |
| B. | A极是正极,电解质溶液可以是盐酸 | |
| C. | B极是负极 | |
| D. | 要判断A极与B极是正极还是负极,还需考虑电解质溶液 |
20.下列有关溶液中粒子浓度的关系式中,正确的是( )


| A. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| B. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| C. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 图中pH=7时c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
7.实验室既可用浓盐酸与MnO2在加热时反应制备Cl2,也可用KMnO4与浓盐酸在常温下反应制备Cl2,下列有关说法中不正确的是( )
| A. | 由题目信息知:KMnO4的氧化性比MnO2的强 | |
| B. | 制备氯气的整个实验过程中,只需要使用氧化剂与还原剂 | |
| C. | 用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体 | |
| D. | 用足量MnO2与含有4 molHCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol |
1.下列说法正确的是( )
| A. | 在101 k Pa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热 量,则C的燃烧热为110.5 kJ/mol | |
| B. | 在10l k Pa时l mol H2完全燃烧生成液态水放出285.8 kJ热量,H2燃烧热为-285.8kJ/mol | |
| C. | 鉴定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |

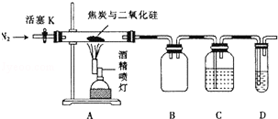 某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究.
某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究. 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题: