题目内容
10.某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.…
(1)步骤Ⅰ中发生反应的化学方程式为2Al+2H2O+2NaOH═2NaAlO2+3H2↑、Al2O3+2NaOH═2NaAlO2+H2O.
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因2Fe3++Fe=3Fe2+.
(3)步骤Ⅲ获得CuSO4溶液的离子方程式为2Cu+O2+4H+═2Cu2++2H2O.
(4)步骤Ⅱ所得滤液经进一步处理可制得Na2FeO4,高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂.
①Na2FeO4中铁元素的化合价是+6价,Na2FeO4具有较强的氧化性(填“氧化性”或“还原性”).
②用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是Fe3++3H2O?4Fe(OH)3(胶体)+3H+(用离子方程式表示).
③工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:
2FeCl3+10NaOH+3NaClO═2Na2FeO4+5H2O+9NaCl.
分析 利用主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3的废金属屑制取新型高效水处理剂Na2FeO4,首先利用铝及其氧化物的两性性质用NaOH溶液溶解后再过滤除去,再用稀硫酸溶液滤渣,得到含有Fe2+、Fe3+的混合溶液并过虑除去铜,副产品Cu可以用热的稀硫酸并通氧气的情况下溶解得到硫酸铜溶液,滤液可通过氧化使溶液里只存在Fe3+,然后滴加NaOH溶液得到Fe(OH)3沉淀,再将经过过滤洗涤得到的Fe(OH)3固体溶解在NaOH和NaClO的混合溶液里可制目标产物;
(1)Al和Al2O3都有两性,加入过量的NaOH溶液,可溶解铝、氧化铝得到可溶性的偏铝酸钠溶液,通过过滤可除去;
(2)步骤Ⅱ在用稀硫酸溶解氧化铁生成硫酸铁,同时混合物中的铁会还原硫酸铁生成硫酸亚铁;
(3)铜能溶解在不断通氧气的热的稀硫酸中得到硫酸铜溶液,反应中氧气作氧化剂,还原产物为水,发生的化学方程式为2Cu+2H2SO4+O2=2CuSO4+2H2O,再改写成离子方程式;
(4)根据化合物中化合价代数和为零可知,高铁酸钠中铁显+6价,有强氧化性,在净水时被还原生成铁离子,铁离子水解生成氢氧化铁胶体,氢氧化铁胶体有吸附性,能吸附水的杂质,工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,根据电子得失守恒和元素守恒可完成化学方程式.
解答 解:(1)利用Al和Al2O3和Fe2O3的两性,用过量的NaOH溶液除去废金属屑中的Al和Al2O3发生反应的化学方程式为2Al+2H2O+2NaOH═2NaAlO2+3H2↑、Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:2Al+2H2O+2NaOH═2NaAlO2+3H2↑、Al2O3+2NaOH═2NaAlO2+H2O;
(2)氧化铁溶于硫酸生成硫酸铁,同时混合物中的铁会还原硫酸铁生成硫酸亚铁,反应的离子方程式:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(3)铜溶解在不断通氧气的热的稀硫酸中得到硫酸铜溶液,发生反应的离子方程式为2Cu+O2+4H+═2Cu2++2H2O,
故答案为:2Cu+O2+4H+═2Cu2++2H2O;
(4)①根据化合物中化合价代数和为零可知,高铁酸钠中铁显+6价,有强氧化性,
故答案为:+6;氧化性;
②在净水时被还原生成铁离子,铁离子水解生成氢氧化铁胶体,氢氧化铁胶体有吸附性,能吸附水的杂质,反应的离子方程式为Fe3++3H2O?4Fe(OH)3(胶体)+3H+,
故答案为:Fe3++3H2O?4Fe(OH)3(胶体)+3H+;
③工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,根据电子得失守恒和元素守恒可知,反应的化学方程式为2FeCl3+10NaOH+3NaClO═2 Na2FeO4+5H2O+9 NaCl,
故答案为:Na2FeO4、H2O、NaCl.
点评 本题考查物质的制备方案的设计,题目难度中等,解答本题时注意把握题给信息,学习中注重知识迁移能力的培养.

 名校课堂系列答案
名校课堂系列答案
| A. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| B. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| C. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 图中pH=7时c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
| A. | 在101 k Pa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热 量,则C的燃烧热为110.5 kJ/mol | |
| B. | 在10l k Pa时l mol H2完全燃烧生成液态水放出285.8 kJ热量,H2燃烧热为-285.8kJ/mol | |
| C. | 鉴定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |

| A. | 以此电池为电源电解精炼铜,当有0.1 mol e-转移时,有3.2 g铜溶解 | |
| B. | 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-═CO32-+2H2O | |
| C. | 该电池使用过程中需补充Li2CO3和K2CO3 | |
| D. | 空气极发生的电极反应式为O2+4e-+2CO2═2CO32- |
| A. | 电解饱和食盐水时,阴极的电极反应式为 2Cl--2e-═Cl2↑ | |
| B. | 放电时,铅蓄电池中硫酸浓度不断减小 | |
| C. | 氢氧燃料电池中,当电路上有1mol 电子通过时,则正极上消耗氧气为5.6L | |
| D. | 以锌片、铜片、稀硫酸组成原电池,当溶液中通过0.2mol电子时,负极减轻6.5g |
| A. | ①=④>③=② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ④>①=③>② |
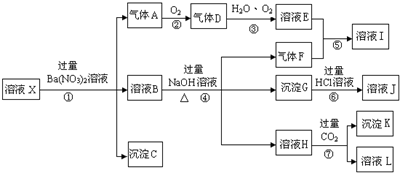
 ,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色. 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题: