题目内容
5.可逆反应A(g)+3B(g)?2C( g),取2mol/L A和5mol/L B置于一个5L的密闭容器中,2min后,测得容器内A的浓度为1.6mol/L.这2min内v(B)=0.6mol/(L•min),v(C)=0.4mol/(L•min),此时,容器内C的物质的量是4mol.分析 平衡时参加反应的△c(A)=(2-1.6)mol/L=0.4mol/L,则V(A)=$\frac{△c}{△t}$=$\frac{0.4mol/L}{2min}$=0.2mol/(L•min),同一可逆反应同一时间内各物质的反应速率之比等于其计量数之比,据此计算B、C的平均反应速率;
同一可逆反应同一时间内参加反应的各物质的物质的量之比等于计量数之比,据此计算平衡时容器内C物质的量;
解答 解:平衡时参加反应的△c(A)=(2-1.6)mol/L=0.4mol/L,则V(A)=$\frac{△c}{△t}$=$\frac{0.4mol/L}{2min}$=0.2mol/(L•min),同一可逆反应同一时间内各物质的反应速率之比等于其计量数之比,则B的平均反应速率=3V(A)=3×0.2mol/(L•min)=0.6mol/(L•min),C的平均反应速率=2V(A)=2×0.2mol/(L•min)=0.4mol/(L•min);
同一可逆反应同一时间内参加反应的各物质的物质的量之比等于计量数之比,衡时参加反应的A物质的量△n(A)=(2-1.6)mol/L×5L=2mol,参加反应的A、C的物质的量之比为1:2,所以平衡时容器内C的物质的量=2△n(A)=2×2mol=4mol;
故答案为:0.6mol/(L•min),0.4mol/(L•min),4;
点评 本题考查化学反应速率的有关计算,侧重考查学生分析计算能力,注意同一可逆反应同一时间内各物质的反应速率之比等于其计量数之比,题目难度不大.

练习册系列答案
相关题目
11.用NA表示阿伏伽德罗常数的值.下列叙述中不正确的是( )
| A. | 16.9g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA | |
| B. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目小于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
12.关于有机物的性质,下列说法不正确的是( )
| A. | CH4气体能与Cl2在光照条件下发生取代反应生成CCl4 | |
| B. | CH2=CH2能使酸性高锰酸钾溶液褪色是因为发生了氧化反应 | |
| C. | 通常情况下,苯是无色气体,能在催化剂条件下与Br2发生单取代反应 | |
| D. | 乙醇和乙酯发生酯化反应生成乙酸乙酯是可逆反应 |
16.我国科研人员研制出一种新型的可充放电Cu/PbO2酸性单液流电池,该电池放电时的总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )
| A. | 放电时的Cu为负极 | |
| B. | 充电时电解液的pH升高 | |
| C. | 充电时阳极电极反应为:PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 每消耗1molCu,电解质溶液中转移2mol电子 |
10.以下命题,违背化学变化规律的是( )
| A. | 石墨制成金刚石 | B. | 煤加氢变成人造石油 | ||
| C. | 水变成汽油 | D. | 干冰转化成原子晶体 |
15.海水中蕴藏着丰富的资源,海水综合利用的流程图如图1:
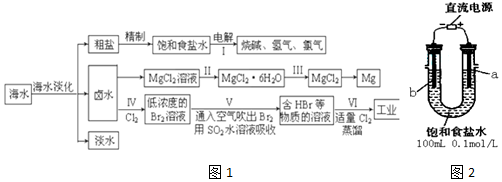
(一)某化学研究小组用图装置2模拟步骤I电解食盐水 (用铁和石墨做电极).
(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+. 表是生成氢氧化物沉淀的pH:
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,最适宜选用的物质是b(填序号,下同),加入c调节溶液的pH,充分反应后过滤,可得MgCl2溶液.
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2•H2O获得MgCl2的操作是:将MgCl2•6H2O在干燥的HCl气流中加热.

(一)某化学研究小组用图装置2模拟步骤I电解食盐水 (用铁和石墨做电极).
(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+. 表是生成氢氧化物沉淀的pH:
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2•H2O获得MgCl2的操作是:将MgCl2•6H2O在干燥的HCl气流中加热.
