题目内容
11.用NA表示阿伏伽德罗常数的值.下列叙述中不正确的是( )| A. | 16.9g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA | |
| B. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目小于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
分析 A、求出过氧化钡的物质的量,然后根据过氧化钡由钡离子和过氧根构成来分析;
B、乙烯和环丁烷的最简式均为CH2;
C、氯气和水的反应为可逆反应;
D、合成氨的反应为可逆反应.
解答 解:A、16.9g过氧化钡的物质的量为0.1mol,而过氧化钡由钡离子和过氧根构成,故0.1mol过氧化钡中含0.2NA个离子,故A正确;
B、乙烯和环丁烷的最简式均为CH2,故28g混合物中含2molCH2,则含2NA个碳原子,故B正确;
C、氯气和水的反应为可逆反应,不能进行彻底,且和水的反应为歧化反应,故0.1mol氯气溶于水后转移电子小于0.1NA个,故C正确;
D、合成氨的反应为可逆反应,不能进行彻底,故转移的电子数小于0.6NA个,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
1.CuI是一种白色不溶于水的固体,以石墨(阴)和铜(阳)为电极组成电解槽,以含酚酞和淀粉的KI水溶液为电解液进行电解.电解开始不久,阴极区溶液显红色,而阳极区仍为无色.过了相当长的时间后,阳极区才呈蓝色,则电解开始时的电极反应为( )
| A. | 阳极反应:Cu-2e-═Cu2+ 阴极反应:Cu2++2e-═Cu | |
| B. | 阳极反应:2Cu-2e-+2I-═2CuI 阴极反应:2H++2e-═H2↑ | |
| C. | 阳极反应:2I--2e-═I2 阴极反应:2H++2e-═H2↑ | |
| D. | 阳极反应:Cu-2e-═Cu2+ 阴极反应:2H++2e-═H2↑ |
2.下列有关化学反应表达正确的是( )
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: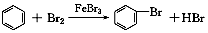 | |
| B. | 蛋壳溶于食醋:CaCO3+CH3COOH=CH3COOCa+H2O+CO2↑ | |
| C. | 甲醛溶液中加入足量新制碱性Cu(OH)2悬浊液并加热HCHO+2 Cu(OH)2+NaOH$\stackrel{△}{→}$ HCOONa+Cu2O↓+3H2O | |
| D. | 向氯乙烷水溶液中加入氢氧化钠溶液共热:CH3CH2Cl+NaOH $→_{△}^{水}$ CH2=CH2+NaCl+H2O |
19.用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)该实验中,量取50mL盐酸或NaOH溶液,需要用到的仪器有50mL量筒和胶头滴管;
(2)某同学实验记录的数据如上表所示,其中记录的终止温度是指全反应后混合溶液的最高温度;
(3)计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度起始温度
(5)若改用60mL0.5mol•L-1盐酸跟50mL0.55mol•L-1氢氧化钠进行反应,实验操作均正确,与上述实验相比,所求的中和热相等(填相等或不相等).
| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)某同学实验记录的数据如上表所示,其中记录的终止温度是指全反应后混合溶液的最高温度;
(3)计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度起始温度
(5)若改用60mL0.5mol•L-1盐酸跟50mL0.55mol•L-1氢氧化钠进行反应,实验操作均正确,与上述实验相比,所求的中和热相等(填相等或不相等).
6.在水溶液中能大量共存的一组离子是( )
| A. | NH4+、CO32-、Cl-、NO3- | B. | Pb2+、Fe3+、S2-、SO42- | ||
| C. | NH4+、H+、S2O32-、PO43- | D. | Ca2+、Al3+、Br-、CO32- |
3.水的状态有气态、液态、固态,还有玻璃态.玻璃态水是液态水急速冷却到165K时形成的,无固定形状,不存在晶体,且密度与普通水相同.下列有关叙述正确的是( )
| A. | 当水结成冰时,水分子间的间距会减小,因而密度增大 | |
| B. | 玻璃态水与液态水具有不同酌化学性质 | |
| C. | 玻璃态水是水的一种特殊状态 | |
| D. | 纯净水与食盐水的冰点相同 |
20.下列说法正确的是( )
| A. | 用润湿的pH试纸测定稀碱溶液的pH,测定值偏小 | |
| B. | 用碱式滴定管量取22.00mL的KMnO4溶液 | |
| C. | 在未知液中滴加BaCl2溶液产生白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中一定含有SO42-或SO32- | |
| D. | 实验室制备氢氧化铁胶体的方法是将氢氧化钠稀溶液滴入饱和氯化铁溶液中 |