题目内容
8.利用微生物电池除去废水中的乙酸钠和氯苯,其原理如图所示,下列说法错误的是( )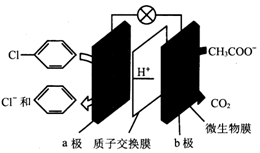
| A. | 该装置能将化学能转化为电能 | |
| B. | a极发生还原反应 | |
| C. | b极电极反应为CH3COO-+2H2O-8e-═2CO2↑+7H+ | |
| D. | 每除去1mol氯苯,电路中转移1mol电子 |
分析 原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知a为正极,正极有氢离子参与反应,电极反应式为 +2e-+H+═
+2e-+H+═ +Cl-,b极为负极,电极反应为CH3COO-+2H2O-8e-═2CO2↑+7H+,以此解答该题.
+Cl-,b极为负极,电极反应为CH3COO-+2H2O-8e-═2CO2↑+7H+,以此解答该题.
解答 解:A.原电池将化学能转化为电能,故A正确;
B.根据原电池中氢离子的移动方向可知a为正极,发生还原反应,故B正确;
C.b极为负极,电极反应为CH3COO-+2H2O-8e-═2CO2↑+7H+,故C正确;
D.据正极有氢离子参与反应,电极反应式为 +2e-+H+═
+2e-+H+═ +Cl-,则每除去1mol氯苯,电路中转移2mol电子,故D错误;
+Cl-,则每除去1mol氯苯,电路中转移2mol电子,故D错误;
故选:D.
点评 本题涉及原电池的工作原理以及应用的考查,为高频考点,侧重于学生的分析能力的考查,注意知识的迁移和应用是解题的关键,难度中等.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
18.如图所示分离混合物时常用的仪器,从左至右,对应的混合物分离操作方法正确的是( )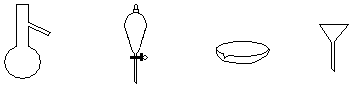

| A. | 蒸发、过滤、蒸馏、分液 | B. | 蒸馏、分液、蒸发、过滤 | ||
| C. | 蒸馏、过滤、蒸发、分液 | D. | 蒸发、分液、蒸馏、过滤 |
16.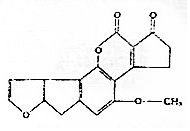 黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
 黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )| A. | 黄曲霉素分子中所有的原子均共面 | |
| B. | 黄曲霉素分子中含有2个手性碳原子 | |
| C. | 黄曲霉素可以发生取代,加成,氧化反应 | |
| D. | 1mol黄曲霉素最多能与7molH2发生加成反应 |
3.在Ag+催化作用下,Cr3+被S2O82-氧化为Cr2O72-的机理为:S2O82-+2Ag+=2SO42-+2Ag2+ 慢2Cr3++6Ag2++7H2O=6Ag++14H++Cr2O72-快下列有关说法正确的是( )
| A. | 反应速率与Ag+浓度有关 | B. | Ag2+也是该反应的催化剂 | ||
| C. | Ag+能降低该反应的活化能和焓变 | D. | v(Cr3+)=v(S2O82-) |
2.下列说法不正确的是( )
| A. | 核外电子排布为1s22s22p43s2的原子处于激发态 | |
| B. | 某元素质量数51,中子数28,其基态原子中未成对电子数为1 | |
| C. | 若某基态原子的外围电子排布为4d15s2,该元素原子核外有5个电子层 | |
| D. | BF3中B原子sp2杂化,为平面三角形 |
9.类比是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2,为验证该观点是否正确,该同学将一定量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分.探究过程如下:
请填空:
(1)提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是FeCl3和FeCl2的混合物
(2)设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如表:
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3.
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是D.
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.在A溶液中加入淀粉KI溶液,溶液变蓝色
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液中热蒸干并灼烧,得到FeCl3固体
(5)已知25℃时Ksp=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2.5 mL 2mol/L的盐酸(忽略加入盐酸体积).加入盐酸的目的是:抑制氯化铁水解.
请填空:
(1)提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是FeCl3和FeCl2的混合物
(2)设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如表:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是D.
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.在A溶液中加入淀粉KI溶液,溶液变蓝色
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液中热蒸干并灼烧,得到FeCl3固体
(5)已知25℃时Ksp=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2.5 mL 2mol/L的盐酸(忽略加入盐酸体积).加入盐酸的目的是:抑制氯化铁水解.
6.下列反应中硝酸既表现出了强氧化性又表现了酸性的是( )
| A. | 氧化铁与硝酸反应 | B. | 氢氧化铜与硝酸反应 | ||
| C. | 木炭粉与浓硝酸反应 | D. | 铜与硝酸反应 |
7.在3Cl2+6KOH→KClO3+5KCl+3H2O的反应中,被氧化的氯元素与被还原的氯元素的质量之比为( )
| A. | 2:1 | B. | 5:1 | C. | 1:1 | D. | 1:5 |