题目内容
7.在3Cl2+6KOH→KClO3+5KCl+3H2O的反应中,被氧化的氯元素与被还原的氯元素的质量之比为( )| A. | 2:1 | B. | 5:1 | C. | 1:1 | D. | 1:5 |
分析 反应3Cl2+6KOH $\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O中,Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,该反应中转移5e-,以此来解答.
解答 解:由反应3Cl2+6KOH $\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O可知,1molCl被氧化,5molCl被还原,则被氧化的氯元素的质量为被还原的氯元素质量的$\frac{1}{5}$倍,
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子数的考查,题目难度不大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
8.利用微生物电池除去废水中的乙酸钠和氯苯,其原理如图所示,下列说法错误的是( )
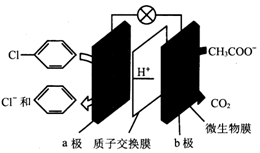

| A. | 该装置能将化学能转化为电能 | |
| B. | a极发生还原反应 | |
| C. | b极电极反应为CH3COO-+2H2O-8e-═2CO2↑+7H+ | |
| D. | 每除去1mol氯苯,电路中转移1mol电子 |
18.下列的分离方法不正确的是( )
| A. | 用过滤的方法除去食盐中的泥沙 | |
| B. | 用蒸馏的方法将自来水制成蒸馏水 | |
| C. | 用酒精萃取溴水中的溴 | |
| D. | 用蒸发浓缩、降温结晶、过滤的方法从硝酸钾和氯化钠的混合溶液中获得硝酸钾晶体 |
15.X、Y为两种主族元素,其原子的最外层电子数分别为1和6,则X、Y两种元素形成的化合物( )
| A. | 一定是离子化合物 | |
| B. | 一定是共价化合物 | |
| C. | 一定形成X2Y型化合物 | |
| D. | 可能含有离子键、极性键、非极性键中的一种或两种 |
2.下列物质中,长期露置在空气中不会变质的是( )
| A. | AgI | B. | 漂白粉 | C. | 食盐 | D. | 次氯酸溶液 |
12.将混有少量泥沙的碘的混合物分离最佳方法是( )
| A. | 将混合物溶于水 | B. | 将混合物加热使碘升华 | ||
| C. | 将混合物倒入NaOH溶液 | D. | 将混合物倒入酒精中充分溶解 |
19.萃取碘水中的碘,可用的萃取剂是( )
①四氯化碳 ②汽油 ③酒精 ④苯 ⑤甲苯.
①四氯化碳 ②汽油 ③酒精 ④苯 ⑤甲苯.
| A. | 只有① | B. | ①②④和⑤ | C. | ①和③ | D. | ①②③ |
17.下列叙述正确的是( )
| A. | 物质的量浓度相同的溶液中所含溶质的微粒数相同 | |
| B. | 氢氧根离子的摩尔质量是17克 | |
| C. | 0.1摩HCl气体约含6.02×1022个HCl分子 | |
| D. | 在标准状况下,1摩SO3的体积约22.4升 |