题目内容
7.根据下列操作及现象,判断所得结论正确的是( )| 序号 | 操作及现象 | 结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度: CO32->HCO3- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸性条件下,Fe2+能被NO3-氧化生成Fe3+;
B.常温下,Na2CO3溶解度大于NaHCO3,要比较两种钠盐水解程度相对大小时钠盐溶液浓度必须相同;
C.盐类水解是吸热反应,升高温度促进水解;
D.NH4+和OH-反应生成一水合氨,加热时才能生成氨气.
解答 解:A.酸性条件下,Fe2+能被NO3-氧化生成Fe3+,同时生成NO,所以Fe(NO3)2与H2SO4反应,故A错误;
B.常温下,Na2CO3溶解度大于NaHCO3,要比较两种钠盐水解程度相对大小时钠盐溶液浓度必须相同,因为两种钠盐饱和溶液浓度不等,所以不能根据溶液pH判断常温下水解程度:CO32->HCO3-,故B错误;
C.向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色,铁离子呈黄色、氢氧化铁呈红褐色,该实验说明升高温度导致氯化铁水解程度增大,故C正确;
D.NH4+和OH-反应生成一水合氨,加热时才能生成氨气,没有加热时没有氨气生成,所以不能根据该实验现象判断是否含有铵根离子,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、盐类水解、氧化还原反应等知识点,明确实验原理及物质性质是解本题关键,易错选项是AB,注意隐含条件的挖掘,题目难度不大.

练习册系列答案
相关题目
17.既可以通过单质与单质化合,也可以通过溶液中的复分解反应来制得的化合物是( )
| A. | Na2O | B. | Na2O2 | C. | FeCl2 | D. | FeS |
18.铝空气海水电池:以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为4Al+3O2+6H2O═4Al(OH)3
正极电极反应式:O2+2H2O+4e-=4OH-.
正极电极反应式:O2+2H2O+4e-=4OH-.
15.下列说法不正确的是( )
| A. | H2在Cl2中燃烧会产生苍白色火焰 | |
| B. | 氯水用于漂白表现了HClO的强氧化性 | |
| C. | 漂白粉是混合物,其有效成分是氯化钙 | |
| D. | 漂白粉应密封保存 |
12.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| C. | 用水可区分苯和溴苯 | |
| D. | 结构如图( )的物质其一氯代物有4种 )的物质其一氯代物有4种 |
19.下列制备和收集气体的实验装置合理的是( )
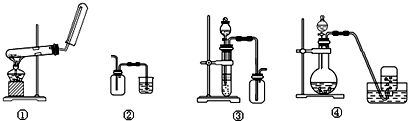

| A. | 装置①:用氯化铵和氢氧化钙制NH3 | B. | 装置②:收集NO气体 | ||
| C. | 装置③:用锌粒和稀硫酸制H2 | D. | 装置④:用双氧水和二氧化锰制O2 |
17.某强酸性溶液中可以大量共存的离子组是( )
| A. | K+、NO3-、OH-、Cl- | B. | SO42-、Mg2+、Cl-、Na+ | ||
| C. | SO42-、Na+、Mg2+、SO32- | D. | Cl-、SCN-、K+、Fe3+ |
