题目内容
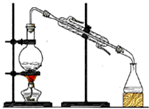
16.从海水中提取溴的方法之一是:①将氯气通入从海水提取食盐后的母液中;②用热空气把溴吹出;③用碳酸钠溶液吸收溴生成NaBr、NaBrO3和CO2;④在上述溶液中加入稀硫酸使溴析出;⑤加汽油、振荡⑥静置,分液.根据以上叙述回答下列问题:(1)①中反应的离子方程式是Cl2+2Br-=Br2+2Cl-;
(2)⑤中不能使用酒精的原因是酒精是易溶于水,在水溶液中不能分层;
(3)⑥中必须使用的玻璃仪器有分液漏斗.
分析 (1)海水提取食盐后的母液中含有溴离子,通入氯气是氧化剂,可以氧化溴离子为溴单质;
(2)萃取剂是在水溶液中分层,萃取的物质溶解性在萃取剂中比水中大;
(3)分液操作是在分液漏斗中静置分层后进行分液.
解答 解:(1)海水提取食盐后的母液中含有溴离子,通入氯气是氧化剂,可以氧化溴离子为溴单质;,反应的离子方程式为:Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
(2)萃取剂是在水溶液中分层,萃取的物质溶解性在萃取剂中比水中大,酒精是易溶于水的物质,在水溶液中不能分层,不能做萃取剂,
故答案为:酒精是易溶于水,在水溶液中不能分层;
(3)分液操作是在分液漏斗中静置分层后进行分液,必须使用的玻璃仪器是分液漏斗,
故答案为:分液漏斗.
点评 本题考查了海水提溴的反应原理,萃取分液的实验基本操作和仪器选择,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
7.根据下列操作及现象,判断所得结论正确的是( )
| 序号 | 操作及现象 | 结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度: CO32->HCO3- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
11.下列实验操作能达到目的是( )
| A. | 除去苯中混有的少量苯酚:加入适量浓溴水,振荡、静置后过滤 | |
| B. | 实验室制备乙酸丁酯:水浴加热 | |
| C. | 分离乙酸乙酯和饱和碳酸钠溶液:分液 | |
| D. | 检验FeCl3溶液中是否含有Fe2+:取少量溶液先滴加氯水,再滴加KSCN溶液 |
1.盛放在油罐车内的石油产品,震荡时可产生静电引起火灾,所以油罐车尾部有一条拖地的铁链,这是利用铁的( )
| A. | 延展性 | B. | 导电性 | C. | 硬度小 | D. | 熔点高 |
8.常温下,下列溶液可以使酚酞无色、甲基橙显黄色的是( )
| A. | pH=3 | B. | C(OH-)=10-8mol/l | C. | pH=11 | D. | C(H+)=10-4mol/l |
5.下列变化属于物理变化的是( )
| A. | 漂粉精露置在空气中变质 | B. | 食物腐败 | ||
| C. | 新制氯水放置一段时间后颜色变浅 | D. | 用四氯化碳萃取溴水中的溴 |


 、
、 .
. .
. 、
、 、
、 、
、 .
.