题目内容
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、在0.1 mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1 mol/L Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| C、向0.2mol/LNaHCO3溶液中加入等体积0.1 mol/LNaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、0.2 mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.碳酸氢钠溶液呈碱性,说明HCO3-的水解程度大于电离程度;
B.碳酸钠溶液中存在质子守恒,根据质子守恒判断;
C.二者混合溶液溶液中的溶质为等物质的量浓度的NaHCO3和Na2CO3,碳酸根离子水解程度远远大于碳酸氢根离子;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
B.碳酸钠溶液中存在质子守恒,根据质子守恒判断;
C.二者混合溶液溶液中的溶质为等物质的量浓度的NaHCO3和Na2CO3,碳酸根离子水解程度远远大于碳酸氢根离子;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答:
解:A.碳酸氢钠溶液呈碱性,说明HCO3-的水解程度大于电离程度,则c(CO32-)<c(H2CO3),故A错误;
B.碳酸钠溶液中存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),所以得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故B错误;
C.二者混合溶液溶液中的溶质为等物质的量浓度的NaHCO3和Na2CO3,碳酸根离子水解程度远远大于碳酸氢根离子,则c(CO32-)<c(HCO3-),故C错误;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),根据物料守恒得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),所以得c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故D正确;
故选D.
B.碳酸钠溶液中存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),所以得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故B错误;
C.二者混合溶液溶液中的溶质为等物质的量浓度的NaHCO3和Na2CO3,碳酸根离子水解程度远远大于碳酸氢根离子,则c(CO32-)<c(HCO3-),故C错误;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),根据物料守恒得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),所以得c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故D正确;
故选D.
点评:本题考查了离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,再结合电荷守恒、物料守恒、质子守恒来分析解答,注意C选项中根据离子水解程度分析,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.下列做法与社会可持续发展理念相违背的是( )
| A、禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
| B、过度开采矿物资源,促进地方经济发展 |
| C、改进汽车尾气净化技术,减少大气污染物的排放 |
| D、开发利用可再生能源,减少化石燃料的使用 |
下列物质与其用途完全符合的是( )
①Na2CO3制玻璃 ②SiO2太阳能电池 ③AgI人工降雨 ④NaCl制纯碱 ⑤Al2O3焊接钢轨 ⑥NaClO消毒剂 ⑦Fe2O3红色油漆或涂料⑧HF(aq)雕刻玻璃.
①Na2CO3制玻璃 ②SiO2太阳能电池 ③AgI人工降雨 ④NaCl制纯碱 ⑤Al2O3焊接钢轨 ⑥NaClO消毒剂 ⑦Fe2O3红色油漆或涂料⑧HF(aq)雕刻玻璃.
| A、①③④⑥⑦⑧ |
| B、①②③⑤⑥⑦⑧ |
| C、①③⑤⑦⑧ |
| D、①②③④⑤⑥⑦ |
在恒温恒容条件下,一定能使反应A(g)+B(s)?C(g)+D(g)的反应速率增大的措施是( )
| A、减小A或B的用量 |
| B、减小C的量 |
| C、增大B的量 |
| D、增大D的量 |
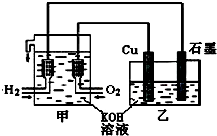 利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )| A、乙中Cu电极的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O |
| B、甲中通入氧气的电极为负极 |
| C、乙中阴离子向石墨电极移动 |
| D、电路上通过0.5mol电子,可制得0.5mol Cu2O |
230Th和232Th是钍的两种同位素,232Th可以转化成
U.下列有关Th、U的说法正确的是( )
233 92 |
A、铀(U)是92号元素,
| ||
| B、Th元素的相对原子质量是231 | ||
| C、232Th转换成233U是化学变化 | ||
| D、230Th和232Th的性质不同 |
下列说法错误的是( )
| A、含有共价键的化合物不一定是共价化合物 |
| B、在共价化合物中一定含有共价键 |
| C、含有离子键的化合物一定是离子化合物 |
| D、离子键就是阴阳离子结合成化合物的静电引力 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、7.8 g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 |
| B、5.6 g铁与足量的稀硝酸反应,失去电子数为0.2NA |
C、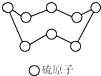 32g硫(结构见图)含S-S的数目为NA 32g硫(结构见图)含S-S的数目为NA |
| D、含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA |
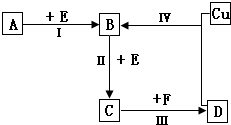 有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题: