题目内容
7.在一定温度下,将气体X和气体Y 各0.16mol充入10L 恒容密闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,反应过程中测定的数据如表( )| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率v(Z)=2.0×10-3 mol/(L•min) | |
| B. | 其他条件不变,降低温度,平衡向正反应方向移动 | |
| C. | 当进行4分钟时,反应已达平衡状态 | |
| D. | 其他条件不变,通过缩小容器体积增大压强,平衡常数减小 |
分析 A.结合v=$\frac{△c}{△t}$计算;
B.△H<0,可知反应为放热反应;
C.由4~7minY的物质的量减少可知,7min时Y的物质的量不再减少;
D.K只与温度有关.
解答 解:A.反应前2min的平均速率v(Y)=$\frac{\frac{0.16mol-0.12mol}{10L}}{2min}$=2.0×10-3 mol/(L•min),由反应速率之比等于化学计量数之比可知反应前2min的平均速率v(Z)=4.0×10-3 mol/(L•min),故A错误;
B.△H<0,可知反应为放热反应,则其他条件不变,降低温度,平衡向正反应方向移动,故B正确;
C.由4~7minY的物质的量减少可知,7min时Y的物质的量不再减少,则4分钟时,反应没有达平衡状态,而7分钟时反应已达平衡状态,故C错误;
D.K只与温度有关,则其他条件不变,通过缩小容器体积增大压强,平衡常数不变,故D错误;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握K只与温度有关、平衡的特征等为解答的关键,侧重分析与应用能力的考查,注意表格中数据的分析,题目难度不大.

练习册系列答案
相关题目
3.柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源.液体矿床以钾矿为主,伴生着镁、溴等多种矿产.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如图1流程:
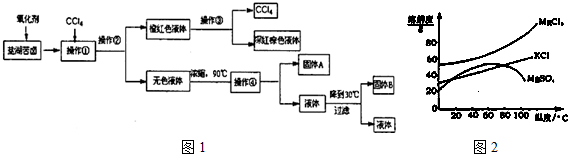
请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是分液漏斗.
(2)参照图2溶解度曲线,得到的固体A的主要成分是MgSO4(填化学式).
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
【设计除杂过程】
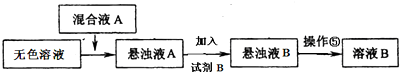
①已知试剂B是K2CO3溶液,则混合液A的主要成分是Ba(OH)2(或BaCl2和KOH)(填化学式).
【获取纯净氯化钾】
②对溶液B加热并不断滴加l mol•L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.该操作的目的是加盐酸调节至pH=5目的是除去未反应的OH-和CO32-.
③将溶液C倒入 蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到出现较多晶体,剩余较少水时时(填现象),停止加热.
【问题讨论】
④进行操作⑤中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为1.6×10-7mol/L.

请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是分液漏斗.
(2)参照图2溶解度曲线,得到的固体A的主要成分是MgSO4(填化学式).
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |

①已知试剂B是K2CO3溶液,则混合液A的主要成分是Ba(OH)2(或BaCl2和KOH)(填化学式).
【获取纯净氯化钾】
②对溶液B加热并不断滴加l mol•L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.该操作的目的是加盐酸调节至pH=5目的是除去未反应的OH-和CO32-.
③将溶液C倒入 蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到出现较多晶体,剩余较少水时时(填现象),停止加热.
【问题讨论】
④进行操作⑤中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为1.6×10-7mol/L.
2.下列说法正确的是( )
| A. | 将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为20% | |
| B. | 某物质中只含有一种元素,则该物质一定是纯净物 | |
| C. | 只有一种元素的阳离子和一种元素的阴离子构成的物质一定是纯净物 | |
| D. | 盐形成的溶液中,既不能电离出H+,也不能电离出OH- |
12.氢气还原氧化铜:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,该反应中( )
| A. | H2作氧化剂 | B. | 铜元素化合价升高 | ||
| C. | 氢元素化合价降低 | D. | Cu是还原产物 |
19.下列叙述正确的是( )
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 原电池是自发的氧化还原反应,电解池发生的是不自发的氧化还原发应 | |
| C. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量大 | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
16.对于下列有机物,说法中正确的是( )


| A. | 它是苯酚的同系物 | |
| B. | 1mol该有机物能与溴水反应消耗2molBr2发生取代反应 | |
| C. | 1mol该有机物能与金属钠反应产生0.5molH2 | |
| D. | 1mol该有机物能与2molNaOH反应 |
17.依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是( )
| A. | 卤素单质 Cl2、Br2、I2的氧化性强弱 | |
| B. | 气态氢化物 NH3、H2O、HF 的稳定性 | |
| C. | 碱金属单质 Li、Na、K 与水反应的剧烈程度 | |
| D. | 1mol Na、Mg、Al 分别与足量盐酸反应时失电子数的多少 |