题目内容
10.水在自然界有“自净化”功能,其净化过程是将水中的有机污染物自发地转变为简单的无机物,但需水中有一定的氧气,才能使转化过程完成:有机物+O2→CO2+H2O1L水中含有的有机物转化为无机物所需要的氧气量,叫做“生化需氧量”,用BOD表示,单位为g•L-1.若水中含氧气的量比BOD少,水质就变坏、发臭,水生动植物则不能生存.
某河水中含有机物A(A的组成用C6H10O5表示,设河水的密度为1.00g•cm-3.)
(1)假设该河水能自动净化,其净化过程可用化学方程式表示为:C6H10O5+6O2→6CO2+5H2O
(2)在正常情况下,氧气在水中溶解量为0.00920g•L-1,若该河水中水生动植物能生存,则河水中含有机物A的质量分数不超过百万分之7.76.
分析 (1)根据题干信息有机物+O2→CO2+H2O,书写C6H10O5净化过程化学方程式;
(2)根据反应的化学方程式结合出氧气的质量计算有机物的质量.
解答 解:(1)C6H10O5与氧气反应生成二氧化碳和水,该反应的化学方程式为:C6H10O5+6O2→6CO2+5H2O,
故答案为:C6H10O5+6O2→6CO2+5H2O;
(2)20℃,河水的密度为1.00g•cm-3,1L水的质量为1000g,在正常情况下,氧气在水中溶解量为0.00920g•L-1,含有氧气的质量为:1L×0.00920g•L-1=9.2×10-3g,
设消耗氧气的有机物C6H10O5质量为x
C6H12O5+6O2→6CO2+5H2O
162 192
x 9.2×10-3g
解得:x=7.7625×10-3g
设河水中含有机物A的质量分数为y,则$\frac{7.7625×1{0}^{-3}}{1000+7.7625×1{0}^{-3}+9.2×1{0}^{-3}}$=$\frac{y}{1{0}^{6}}$,y≈7.76,
故答案为:7.76.
点评 本题考查水净化需氧量的有关计算,根据题目信息,找出反应物和生成物,再利用书写化学方程式的方法及步骤,根据质量守恒定律,正确书写化学方程式,根据化学方程式生化需氧量进行计算,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列相关的说法不正确的是( )
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 工业粉尘中含有Pb、Cd、Cr、V、As等金属元素,过量摄入均对人体有害 | |
| C. | 用工业明胶制作用药胶囊,会导致过量Cr元素摄入人体而提高致癌风险 | |
| D. | 分光光度计通过测定溶液颜色分析反应物(或生成物)浓度变化,从而确定化学反应速率 |
18.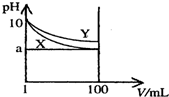 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | Y碱溶液稀释过程中溶液中c(H+)减小 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性弱 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY | |
| D. | 若8<a<10,则X、Y都是弱碱 |
5.某同学设计在KOH溶液中用铂作电极,利用CH3OH和O2的反应来构成原电池.下列说法正确的是①正极上O2得到电子,发生还原反应②每消耗1 mol CH3OH可以向外电路提供6 mol e-③该电池的总反应为2CH3OH+3O2═2CO2+4H2O④电池放电后,溶液的pH不断升高( )
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
15.溶液体积和pH都相同的一元强酸X与一元弱酸溶液Y,已知弱酸的电离度为0.5%,则X和Y溶液分别中和相同浓度的NaOH溶液时,所需Y溶液的体积是X溶液的( )
| A. | 20倍 | B. | 100倍 | C. | 200倍 | D. | 500倍 |
2.下列说法错误的是( )
| A. | 化学反应实质是旧键断裂新键形成,化学反应中的能量变化本质原因就是旧键断裂所吸收的能量和新键形成所释放的能量不同 | |
| B. | 极性键就是共用电子对发生偏移的共价键 | |
| C. | 氢键是一种比较弱的化学键 | |
| D. | 水结冰时体积膨胀、密度减小就是因为氢键的存在 |
19.将Mg和Cu组成的混合物7.64g投入足量的稀硝酸中使其完全反应,得到的唯一还原产物NO在标准状况下体积为2.24L.将反应后的溶液稀释为1L,测得溶液的pH=1,此时溶液中NO3-的浓度为( )
| A. | 0.3 mol/L | B. | 0.4 mol/L | C. | 0.5 mol/L | D. | 0.6 mol/L |
 已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)