题目内容
9.甲、乙、丙、丁均是由Na+、H+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的2种组成,可以发生如图转化,下列说法正确的是( )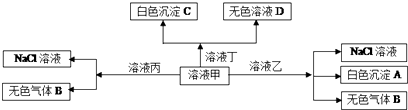
| A. | 甲为AlCl3,乙为NaHCO3 | |
| B. | 在甲中滴加丁开始反应的离子方程式:2HCO3-+Ba2++2OH-B═aCO3↓+2H2O+CO32- | |
| C. | 白色沉淀A不能溶解在溶液丁中 | |
| D. | 在丙中可以大量共存的有:Fe2+、SO42-、NO3- |
分析 甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,依据离子共存原则,H+只能与Cl-生成HCl,Al3+只能与Cl-生成AlCl3,依据甲溶液能和乙溶液生成沉淀,气体和氯化钠,甲和丙生成气体和氯化钠,故甲和乙中含有能双水解的离子,且甲中含有Na+,据此解答即可.
解答 解:溶液中存在H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-,故依据离子能大量共存的原则得出甲乙丙丁中含有两种物质,即:HCl和AlCl3,因为甲溶液能和乙溶液生成沉淀,气体和氯化钠,故甲和乙中含有能双水解的离子,即Al3+和HCO3-生成的气体B为二氧化碳,沉淀A为氢氧化铝,然后依据甲与丙生成气体,则甲为NaHCO3,那么乙为AlCl3,甲与丁生成白色沉淀,则丁含有钡离子且与甲生成沉淀,则丁为氢氧化钡,丙为HCl,
A、依据以上分析得出甲应为碳酸氢钠,故A错误;
B、甲中滴加丁,甲是过量的,那么Ba(OH)2应满足阳离子:阴离子=1:2的关系,故B正确;
C、白色沉淀A为氢氧化铝能溶于强碱氢氧化钡,故C错误;
D、据分析可知,丙为HCl,含有H+,故Fe2+、NO3-不能与其共存,故D错误;
故选B.
点评 本题主要考查的是常见离子之间的反应以及物质的推断,有一定难度,需要认真整理.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
5.下列关于硫酸的说法正确的是( )
| A. | 浓硫酸不能干燥碱性气体NH3,也不可干燥CO、H2等还原性气体 | |
| B. | 常温下,铜片和浓硫酸反应产生的气体可使晶红溶液褪色 | |
| C. | 浓硫酸与磁性氧化铁的反应只表现出浓硫酸的酸性 | |
| D. | 蔗糖与浓硫酸的实验过程及现象表现出浓硫酸具有吸水性、脱水性和强氧化性 |
1.甲、乙两同学在学习了铁的性质后.分别用如下装置进行“Fe粉与水蒸气的反应产物”的实验.
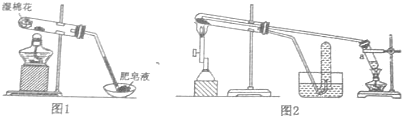
(1)甲同学用图1所示装置进行实验,写出铁粉与H2O蒸气反应的化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,简述证明实验中有氢气产生的实验操作及现象:有大量肥皂泡生成,部分肥皂泡浮在空中,点燃肥皂泡发生轻微爆炸;
(2)乙同学用图2所示装置进行实验.试管a的作用是提供水蒸气;为探究实验结柬后试管内固体物质的成分,乙同学进行了下列实验:
简述步骤Ⅰ中发生反应的离子方程式:Fe3O4+8H+═Fe2++2Fe3++4H2O,Fe+2H+═Fe2++H2↑,简述步骤Ⅱ中“溶液没有出现红色”的原因溶液中三价铁离子可能被过量铁还原为亚铁离子(2Fe3++Fe=3Fe2+).

(1)甲同学用图1所示装置进行实验,写出铁粉与H2O蒸气反应的化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,简述证明实验中有氢气产生的实验操作及现象:有大量肥皂泡生成,部分肥皂泡浮在空中,点燃肥皂泡发生轻微爆炸;
(2)乙同学用图2所示装置进行实验.试管a的作用是提供水蒸气;为探究实验结柬后试管内固体物质的成分,乙同学进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到的黑色固体X,取出少量放人另一试管中,加人少量盐酸,微热 | 黑色粉末逐渐溶解,产生少量气泡 |
| Ⅱ | 向上述实验得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液未出现红色 |
19.元素在周期表中的位置反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A. | 第一主族的元素称为碱金属 | |
| B. | 第二周期元素的最高化合价依次递增,并等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数一定相同 |
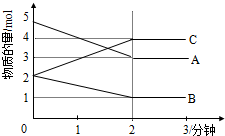 某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色).
某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色).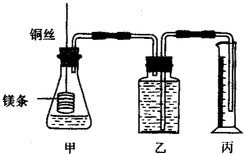 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:
