题目内容
向明矾溶液中加入Ba(OH)2溶液,生成沉淀的物质的量与消耗Ba(OH)2的物质的量的关系如图所示,其中正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:离子方程式的有关计算
专题:
分析:明矾与Ba(OH)2的反应分为两个阶段:开始时,Ba(OH)2不足,Al3+转化为Al(OH)3沉淀,当二者的物质的量之比为2:3时沉淀的物质的量达到最大值;
继续加入Ba(OH)2,则Al(OH)3开始溶解,但BaSO4的物质的量则增加,据此分析图象.
继续加入Ba(OH)2,则Al(OH)3开始溶解,但BaSO4的物质的量则增加,据此分析图象.
解答:
解:反应可分两个阶段:起始阶段,Ba(OH)2不足,反应的化学方程式为:2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4,当二者的物质的量之比为2:3时沉淀的物质的量达到最大值;此后再加入Ba(OH)2,则Al(OH)3溶解,但BaSO4的物质的量则增加,总反应的化学方程式为:KAl(SO4)2+2Ba(OH)2=2BaSO4↓+KAlO2+2H2O,当二者的物质的量之比为1:2时沉淀的物质的量反而减小.据此可知A项图象正确,故选A.
点评:本题考查了明矾与氢氧化钡反应生成沉淀的图象,应注意的是由于生成的两种沉淀,反应分两个阶段.

练习册系列答案
相关题目
下列说法中,正确的是 ( )
| A、标准状况下,1mol任何物质的体积都约为22.4L |
| B、1mol任何气体所含分子数都相同,体积也都约为22.4L |
| C、常温常压下,1molH2的质量是2克 |
| D、同温同压下,相同体积的任何气体单质所含原子数目相同 |
 电解Na2SO4 溶液生产H2SO4 和烧碱的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)( )
电解Na2SO4 溶液生产H2SO4 和烧碱的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)( )| A、a极反应式为:2H++2e-=H2↑ |
| B、产物丙为硫酸 |
| C、d为阴离子交换膜 |
| D、Na2SO4 溶液浓度增大 |
第一位人工合成有机物的化学家是( )
| A、门捷列夫 | B、维勒 |
| C、范特霍夫 | D、勒.贝尔 |

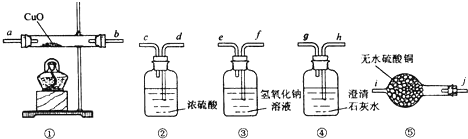
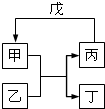 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图5所示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图5所示转化关系的是( )