题目内容
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出元素n的基态原子的价电子排布式 ,元素O在周期表的位置是 ,属于 区.
(2)k在空气中燃烧产物的分子构型为 ,中心原子的杂化方式为 ,该分子是 (填“极性”或“非极性”)分子.
(3)第三周期8种元素按单质熔点高低的顺序如图甲,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图甲中的序号).
(4)i单质晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示.则晶胞中i原子的配位数为 .

| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | O | ||||||||||||||||
(1)请写出元素n的基态原子的价电子排布式
(2)k在空气中燃烧产物的分子构型为
(3)第三周期8种元素按单质熔点高低的顺序如图甲,其中序号“8”代表
(4)i单质晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示.则晶胞中i原子的配位数为

考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)n为24号元素Cr,根据构造原理写出其价电子排布式;O为26号元素铁,处于第三周期、Ⅷ族,属于d区;
(2)k为S,在空气中燃烧生成SO2,计算S原子价层电子对数、孤对电子确定杂化方式与空间结构,根据正负电荷重心是否重合判断分子极性问题;
(3)第三周期8种元素按单质熔点最高的为原子晶体Si;同周期电负性最大的是ⅦA的元素;
(4)该类型为面心立方最密堆积,配位数=3×
×8=12.
(2)k为S,在空气中燃烧生成SO2,计算S原子价层电子对数、孤对电子确定杂化方式与空间结构,根据正负电荷重心是否重合判断分子极性问题;
(3)第三周期8种元素按单质熔点最高的为原子晶体Si;同周期电负性最大的是ⅦA的元素;
(4)该类型为面心立方最密堆积,配位数=3×
| 1 |
| 2 |
解答:
解:(1)元素n是24号元素Cr,价电子排布式为3d54s1,元素O是Fe,在周期表的第三周期、Ⅷ族,属于d区,
故答案为:3d54s1;第四周期、Ⅷ族;d;
(2)k为S,在空气中燃烧生成SO2,S原子价层电子对数=2+
=3,含有1对孤对电子,SO2为V型结构,S原子采取sp2杂化,分子结构不对称,正负电荷重心不重合,为极性分子,
故答案为:角形(或V形); sp2;极性;
(3)序号“8”单质的熔点最高,第三周期8种元素单质熔点最高的为原子晶体Si;呈气体的是Cl2和Ar,其中Cl2的沸点比Ar高,即序号“2”是Cl,同周期电负性最大的是ⅦA的元素,因此电负性最大的Cl,
故答案为:Si; 2;
(4)i是Al,根据图片知,Al单质为面心立方最密堆积,Al原子配位数配位数=3×
×8=12,
故答案为:12.
故答案为:3d54s1;第四周期、Ⅷ族;d;
(2)k为S,在空气中燃烧生成SO2,S原子价层电子对数=2+
| 6-2×2 |
| 2 |
故答案为:角形(或V形); sp2;极性;
(3)序号“8”单质的熔点最高,第三周期8种元素单质熔点最高的为原子晶体Si;呈气体的是Cl2和Ar,其中Cl2的沸点比Ar高,即序号“2”是Cl,同周期电负性最大的是ⅦA的元素,因此电负性最大的Cl,
故答案为:Si; 2;
(4)i是Al,根据图片知,Al单质为面心立方最密堆积,Al原子配位数配位数=3×
| 1 |
| 2 |
故答案为:12.
点评:本题考查位置、结构与性质的关系,题目难度中等,试题涉及元素周期表、核外电子排布规律、杂化理论、分子结构与性质、晶体类型与性质等,侧重考查学生对知识运用、分析解决问题能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列关于胶体的叙述,正确的是( )
| A、胶体区别于其他分散系的本质特征是胶体分散质的微粒直径在10-9~10-7 m之间 | ||||
B、制备氢氧化铁胶体的化学方程式是FeCl3+3H2O
| ||||
| C、用平行光照射NaCl溶液和Fe(OH)3胶体时,产生相同的现象 | ||||
| D、Fe(OH)3胶体能使水中悬浮的固体颗粒沉降,以达到净水的目的,此无菌净水可直接饮用 |
下列有关实验的叙述正确的是( )
| A、蒸干AlCl3溶液可得纯净的无水氯化铝 |
| B、用碱式滴定管量取20.00mL酸性高锰酸钾溶液 |
| C、用pH试纸测定溶液的pH时预先要用蒸馏水湿润 |
| D、实验室配制SnCl2 溶液时,需要加入少量的盐酸 |
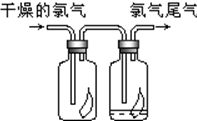 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式