题目内容
 电解Na2SO4 溶液生产H2SO4 和烧碱的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)( )
电解Na2SO4 溶液生产H2SO4 和烧碱的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)( )| A、a极反应式为:2H++2e-=H2↑ |
| B、产物丙为硫酸 |
| C、d为阴离子交换膜 |
| D、Na2SO4 溶液浓度增大 |
考点:电解原理
专题:电化学专题
分析:电解硫酸钠溶液时,阳极上生成氧气,电极反应式为2H2O-4e-=O2↑+4H+,阴极反应式为 2H2O+2e-=H2↑+2OH-,测得同温同压下,气体甲与气体乙的体积比约为1:2,则甲是氧气、乙是氢气,则a是阳极、b是阴极,阳极区域生成硫酸、阴极区域生成NaOH,据此分析解答.
解答:
解:电解硫酸钠溶液时,阳极上生成氧气,电极反应式为2H2O-4e-=O2↑+4H+,阴极反应式为 2H2O+2e-=H2↑+2OH-,测得同温同压下,气体甲与气体乙的体积比约为1:2,则甲是氧气、乙是氢气,则a是阳极、b是阴极,阳极区域生成硫酸、阴极区域生成NaOH,
A.a为阳极,电极反应式为2H2O-4e-=O2↑+4H+,故A错误;
B.通过以上分析知,a为阳极,同时生成硫酸,所以产物丙是硫酸,故B正确;
C.产物丁是NaOH,则离子交换膜d是阳离子交换膜,故C错误;
D.根据以上分析,阳极区域生成硫酸、阴极区域生成NaOH,所以Na2SO4 溶液浓度减小,故D错误;
故选B.
A.a为阳极,电极反应式为2H2O-4e-=O2↑+4H+,故A错误;
B.通过以上分析知,a为阳极,同时生成硫酸,所以产物丙是硫酸,故B正确;
C.产物丁是NaOH,则离子交换膜d是阳离子交换膜,故C错误;
D.根据以上分析,阳极区域生成硫酸、阴极区域生成NaOH,所以Na2SO4 溶液浓度减小,故D错误;
故选B.
点评:本题考查电解原理,判断甲、乙气体成分是解本题关键,再结合电极反应式分析解答,易错选项是D,注意气体摩尔体积的适用范围及适用条件,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
以下各组物质在一定条件下反应,所得产物与反应物的量比关系有关的是( )
| A、AlCl3+NH3?H2O |
| B、Na2CO3+HCl |
| C、Na2CO3(s)+SiO2 |
| D、Na2SiO3+HCl |
设NA表示阿伏加德罗常数,下列叙述中不正确的是( )
| A、同温同压下,相同体积的氢气和氦气具有的原子数均为NA |
| B、1.7g的OH-中含有的电子数为NA |
| C、常温常压下,48gO3含有的氧原子数为3NA |
| D、11.2g 铁粉与5.6L氯气(标准状况下)充分反应后,反应中转移的电子数为0.5 NA |
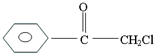
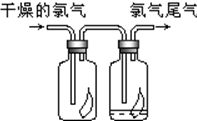 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式



