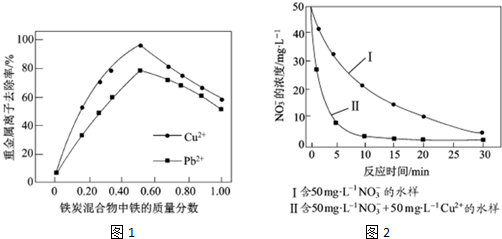
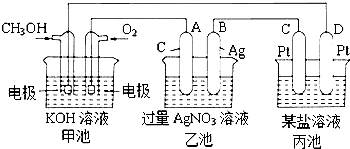
题目内容
3.不能正确表示下列反应的离子方程式是( )| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| B. | Na2O2溶于水产生O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀Ca2++HCO3ˉ+OHˉ=CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体 CO32ˉ+CO2+H2O=2HCO3ˉ |
分析 A.二者反应生成硫酸钠和氢气;
B.二者反应生成氢氧化钠和氧气;
C.碳酸氢钙与氢氧化钠按照物质的量之比为1:1反应,钙离子恰好沉淀完全;
D.碳酸氢钠的溶解度小于碳酸钠的溶解度.
解答 解:A.Na与稀硫酸反应的离子方程式为:2Na+2H+═2Na++H2↑,故A正确;
B.Na2O2溶于水产生O2离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,故B正确;
C.酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀离子方程式为:Ca2++HCO3ˉ+OHˉ=CaCO3↓+H2O,故C正确;
D.向饱和碳酸钠溶液中通入足量二氧化碳气体,离子方程式:2Na++CO32-+H2O+CO2=2NaHCO3↓,故D错误;
故选:D.
点评 本题考查了离子方程式的书写,题目难度不大,解题时应注意化学式的拆分、反应物用量对反应的影响.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
18.如图为铜锌原电池示意图,下列说法正确的是( )


| A. | 电子由铜片通过导线流向锌片 | B. | 锌片是正极,铜片上有气泡产生 | ||
| C. | 锌片逐渐溶解 | D. | 该装置能将电能转变为化学能 |
12.设NA为阿伏伽德罗常数的值.下列有关叙述正确的是( )
| A. | 1molFeCl3完全水解得到的胶体粒子数小于NA | |
| B. | 1molN2与3molH2反应生成的NH3分子数为2NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LSO3含有O原子数为0.3NA |

 .
. .
.