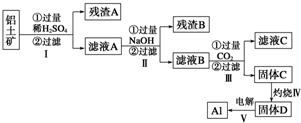
题目内容
18.如图为铜锌原电池示意图,下列说法正确的是( )
| A. | 电子由铜片通过导线流向锌片 | B. | 锌片是正极,铜片上有气泡产生 | ||
| C. | 锌片逐渐溶解 | D. | 该装置能将电能转变为化学能 |
分析 由图中的铜锌原电池可知,Zn活泼,则Zn作负极,Cu作正极,发生电池反应为Zn+H2SO4═ZnSO4+H2↑,电子由负极流向正极,该装置将化学能转变为电能,以此来解答.
解答 解:A.Zn作负极,Cu作正极,则电子由锌片通过导线流向铜片,故A错误;
B.因Zn作负极,Cu不反应,氢离子在铜片上得电子产生氢气,故B错误;
C.因Zn作负极,则Zn失去电子而逐渐溶解,故C正确;
D.该装置通过化学反应将化学能转变为电能,故D错误;
故选C.
点评 本题考查原电池的工作原理,明确电极的判断、电极反应、电池反应、能量转化等即可解答,难度不大.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 2,5-二甲基己烷的核磁氢谱中出现三组峰 | |
| B. | 丙烷分子的比例模型: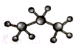 | |
| C. | 四氯化碳分子的电子式: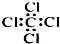 | |
| D. | 化合物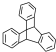 是苯的同系物 是苯的同系物 |
9. 某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:同温度下,Na2CO3比NaHCO3易溶于水.
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是bd(填字母序号).
a.溶液温度下降b.溶液温度升高c.滴入酚酞后呈浅红色d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
①两试管中均产生气体,Ⅰ(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是ac(填字母序号).
a.装置Ⅰ的气球体积较大b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5mol•L-1的溶液,设计如下方案并对反应现象做出预测:
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为Ca2++2HCO3-=CaCO3↓+CO2↑+H2O.
 某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:同温度下,Na2CO3比NaHCO3易溶于水.
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是bd(填字母序号).
a.溶液温度下降b.溶液温度升高c.滴入酚酞后呈浅红色d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
①两试管中均产生气体,Ⅰ(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是ac(填字母序号).
a.装置Ⅰ的气球体积较大b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5mol•L-1的溶液,设计如下方案并对反应现象做出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应::Ca2++CO32-=CaCO3↓(写离子方程式) |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
6.一定温度下,在一固定体积的密闭容器中,能说明可逆反应A(g)+3B(g)?2C(g)达到平衡状态的是( )
①C的生成速率与C的分解速率相等;
②单位时间内生成amolA,同时生成3amolB;
③气体密度不再变化;
④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为l:3:2;
⑥混合气体的平均相对分子质量不变.
①C的生成速率与C的分解速率相等;
②单位时间内生成amolA,同时生成3amolB;
③气体密度不再变化;
④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为l:3:2;
⑥混合气体的平均相对分子质量不变.
| A. | ②④⑤⑥ | B. | ①④⑥ | C. | ①②④⑥ | D. | ①③④⑤ |
3.不能正确表示下列反应的离子方程式是( )
| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| B. | Na2O2溶于水产生O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀Ca2++HCO3ˉ+OHˉ=CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体 CO32ˉ+CO2+H2O=2HCO3ˉ |
10.在下述条件下,一定能大量共存的离子组是( )
| A. | 无色透明的水溶液中:K+、Ba2+、I-、MnO4- | |
| B. | 能与Al反应产生H2的溶液中:HCO3-、Na+、Al3+、Br- | |
| C. | 澄清透明溶液中:K+、Fe3+、HCO3-、AlO2- | |
| D. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |
7.有关氯气和氯水性质的叙述正确的是( )
| A. | 使湿润KI淀粉试纸变蓝色的气体一定是氯气 | |
| B. | 饱和氯水久置时Cl-增多、水分子减少 | |
| C. | 过量的铁在氯气中燃烧可生成氯化亚铁 | |
| D. | 可用pH试纸测定氯水的pH |
8.下列关于有机物性质的说法正确的是( )
| A. | 乙烯可以与氯气反应甲烷不能 | |
| B. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| C. | 乙烯和苯都能使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯和乙烷都可以发生氧化反应 |