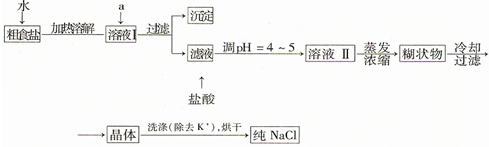
题目内容
18.将一支试管中盛满甲烷和氯气的混合气体,倒置于盛有饱和食盐水的水槽中,在漫射光的照射下,产生的现象是:①颜色变浅,②液面上升,③有油状物生成,④试管中产生少量白雾.分析 甲烷与氯气在光照条件下发生取代反应生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,氯气逐渐减少甚至消失;反应后有油状液滴(二氯甲烷、三氯甲烷与四氯甲烷)生成;反应过程中气体的体积减小,导致试管内的压强低于外界大气压;氯化氢极易溶于水而产生盐酸小液滴.
解答 解:甲烷与氯气在光照条件下发生取代反应生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,氯气逐渐减少甚至消失;反应后有油状液滴(二氯甲烷、三氯甲烷与四氯甲烷)生成;反应过程中气体的体积减小,导致试管内的压强低于外界大气压;氯化氢极易溶于水而产生盐酸小液滴,所以看到的现象是:颜色变浅、液面上升、有油状物生成、试管中产生少量白雾,
故答案为:①颜色变浅②液面上升③有油状物生成④试管中产生少量白雾.
点评 本题考查甲烷和氯气的取代反应现象,侧重考查学生实验操作、实验观察及实验总结能力,明确实验原理及物质性质是解本题关键,注意雾和烟的区别,题目难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
9.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下,8gO2含有4NA个电子 | |
| B. | 任意条件下,16g O3所含的原子数为NA | |
| C. | 由CH4和C2H6组成的混合物中共有NA个分子,其中的氢原子数为5NA | |
| D. | 46 g二氧化氮和46 g四氧化二氮含有的原子数均是6NA |
13.某有机物结构简式为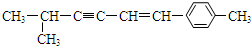 ,下列说法中正确的是( )
,下列说法中正确的是( )
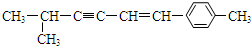 ,下列说法中正确的是( )
,下列说法中正确的是( )| A. | 该分子中所有的碳原子均可能处于同一平面上 | |
| B. | 该分子中一定共面的碳原子数至少为8个 | |
| C. | 该分子中至少有9个碳原子处于同一条直线上 | |
| D. | 该分子中可能共面的碳原子数最多为13个 |
3.下列说法正确的是( )
| A. | 乙烯和甲烷都能发生加成反应 | |
| B. | 煤焦油、石油、花生油都属于烃 | |
| C. | 甲烷、乙烯、苯都可通过石油分馏得到 | |
| D. |  + +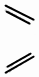 $\stackrel{△}{→}$ $\stackrel{△}{→}$ 反应属于加成反应 反应属于加成反应 |
4.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})^{\;}}{{c}^{2}(NO)c({O}_{2})}$.已知:K300°C>K350°C,则该反应是放热反应.
(2)达到平衡时v(NO)为0.002mol/(L.s).
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内密度保持不变
e.容器内气体的颜色不再变化.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
(2)达到平衡时v(NO)为0.002mol/(L.s).
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内密度保持不变
e.容器内气体的颜色不再变化.
5.工业制硫酸的一种工艺流程如图1所示:

请回答下列问题:
(1)煅烧前需将黄铁矿粉碎,其目的是充分燃烧,提高原料的利用率.
(2)煅烧造气过程中,若每生成1molSO2气体放出427.5kJ热量,煅烧反应的热化学反应方程式是4FeS2(s)+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol.
(3)催化氧化是一个可逆反应,下表是不同条件下的SO2平衡的转化率:
根据上表数据,你认为SO2的催化氧化反应实际生产过程中应选择的条件是温度在400°C左右、压强为1MPa.
(4)吸收尾气过程常用NaOH溶液来吸收SO2,若在30L 0.1mol•L-1 的NaOH溶液中通入标准状况下44.8L SO2气体,其反应的离子方程式为3OH-+2SO2=SO32-+HSO3-+H2O,反应后的溶液pH<7,则溶液中离子浓度由大到小的顺序是c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-).
(5)另一种将SO2转化为硫酸的化工流程如图2.其中催化剂a表面的反应是SO2+2H2O-2e-═SO42-+4H+,该流程理论上参加反应的SO2与加入的H2O的质量比为8:15.

请回答下列问题:
(1)煅烧前需将黄铁矿粉碎,其目的是充分燃烧,提高原料的利用率.
(2)煅烧造气过程中,若每生成1molSO2气体放出427.5kJ热量,煅烧反应的热化学反应方程式是4FeS2(s)+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol.
(3)催化氧化是一个可逆反应,下表是不同条件下的SO2平衡的转化率:
| SO2的转化率% | 0.1MPa | 1MPa | 10MPa |
| 400°C | 99.2 | 99.7 | 99.9 |
| 600°C | 73.7 | 89.5 | 96.4 |
(4)吸收尾气过程常用NaOH溶液来吸收SO2,若在30L 0.1mol•L-1 的NaOH溶液中通入标准状况下44.8L SO2气体,其反应的离子方程式为3OH-+2SO2=SO32-+HSO3-+H2O,反应后的溶液pH<7,则溶液中离子浓度由大到小的顺序是c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-).
(5)另一种将SO2转化为硫酸的化工流程如图2.其中催化剂a表面的反应是SO2+2H2O-2e-═SO42-+4H+,该流程理论上参加反应的SO2与加入的H2O的质量比为8:15.
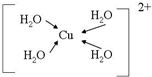 (配位键用→标出).
(配位键用→标出).