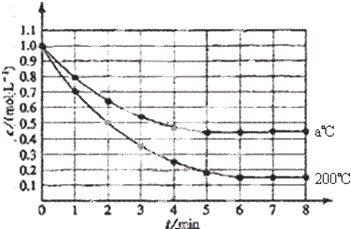
题目内容
物质A、B、C的转化关系如图所示: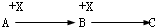
(1)若A 为常见金属,C为淡黄色固体,则C的电子式为 .
(2)若A分子含有10个电子且有刺激性气味的气体,则A的结构式为 ,写出A生成B的反应方程式为: .
(3)若A为黄绿色气体,则A元素在周期表中的位置 .X为常见金属单质,C溶液为浅绿色,写出B与X反应的离子方程式 .
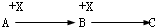
(1)若A 为常见金属,C为淡黄色固体,则C的电子式为
(2)若A分子含有10个电子且有刺激性气味的气体,则A的结构式为
(3)若A为黄绿色气体,则A元素在周期表中的位置
考点:无机物的推断
专题:推断题
分析:(1)A是常见金属,C是淡黄色固体,则A为Na,X为O2,B为Na2O,C为Na2O2;
(2)若A分子含有10个电子且有刺激性气味的气体,则A为NH3,X为O2,B为NO,C为NO2,氨气与氧气反应生成NO与水;
(3)若A为黄绿色气体,则A为Cl2,X为常见金属单质,C溶液为浅绿色,则X为Fe、B为FeCl3,C为FeCl2.
(2)若A分子含有10个电子且有刺激性气味的气体,则A为NH3,X为O2,B为NO,C为NO2,氨气与氧气反应生成NO与水;
(3)若A为黄绿色气体,则A为Cl2,X为常见金属单质,C溶液为浅绿色,则X为Fe、B为FeCl3,C为FeCl2.
解答:
解:(1)A是常见金属,C是淡黄色固体,则A为Na,X为O2,B为Na2O,C为Na2O2,过氧化钠电子式为: ,
,
故答案为: ;
;
(2)若A分子含有10个电子且有刺激性气味的气体,则A为NH3,X为O2,B为NO,C为NO2,氨气的电子式为 ,氨气与氧气反应生成NO与水,反应方程式为:4NH3+5O2
,氨气与氧气反应生成NO与水,反应方程式为:4NH3+5O2
4NO+6H2O,
故答案为: ;4NH3+5O2
;4NH3+5O2
4NO+6H2O;
(3)若A为黄绿色气体,则A为Cl2,则A元素在周期表中的位置为:第三周期 VIIA族,X为常见金属单质,C溶液为浅绿色,则X为Fe、B为FeCl3,C为FeCl2,B与X反应的离子方程式为:2Fe3++Fe=3Fe2+,
故答案为:第三周期 VIIA族;2Fe3++Fe=3Fe2+.
 ,
,故答案为:
 ;
;(2)若A分子含有10个电子且有刺激性气味的气体,则A为NH3,X为O2,B为NO,C为NO2,氨气的电子式为
 ,氨气与氧气反应生成NO与水,反应方程式为:4NH3+5O2
,氨气与氧气反应生成NO与水,反应方程式为:4NH3+5O2
| ||
| △ |
故答案为:
 ;4NH3+5O2
;4NH3+5O2
| ||
| △ |
(3)若A为黄绿色气体,则A为Cl2,则A元素在周期表中的位置为:第三周期 VIIA族,X为常见金属单质,C溶液为浅绿色,则X为Fe、B为FeCl3,C为FeCl2,B与X反应的离子方程式为:2Fe3++Fe=3Fe2+,
故答案为:第三周期 VIIA族;2Fe3++Fe=3Fe2+.
点评:本题考查无机物的推断,难度不大,注意根据物质的颜色判断物质,需要学生熟练掌握元素化合物知识.

练习册系列答案
相关题目
某气体的摩尔质量为M g?mol-1,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为x.则
表示的是( )
| Mx |
| VNA |
| A、该气体的密度(以g/L为单位) |
| B、VL该气体的质量(以g为单位) |
| C、1mol该气体的体积(以L为单位) |
| D、1L该气体中所含的分子数 |
下列物质分类正确的是( )
| A、波尔多液、工业酒精、氨水均为混合物 |
| B、稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C、烧碱、冰醋酸、四氯化碳均为电解质 |
| D、SO2、SiO2、CO均为酸性氧化物 |
下列有关能量的说法不正确的是( )
| A、化石能源物质内部贮存着大量的能量 |
| B、植物的光合作用使太阳能转化为化学能 |
| C、由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低 |
| D、燃料燃烧时只是将化学能转化为热能 |