题目内容
1. 在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )
在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )| A. | 1:1 | B. | 3:1 | C. | 2:1 | D. | 1:2 |
分析 首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液50mL,计算沉淀Mg2+消耗的氢氧化钠溶液的体积,据此确定溶液中n(AlCl3):n(MgSO4),据此计算解答.
解答 解:首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积为10mL×3=30mL,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液50mL,则沉淀Mg2+消耗的氢氧化钠溶液的体积为50mL-30mL=20mL,则n(AlCl3):n(MgSO4)=$\frac{1}{2}$×20mL:$\frac{1}{3}$×30mL=1:1,
故选A.
点评 本题考查镁铝化合物性质、混合物的有关计算,难度中等,注意根据图象中氢氧化钠的体积以及发生的反应来分析解答,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
11.设NA为阿伏加德罗常数,下列叙述中不正确的是( )
| A. | 46g NO2和N2O4混合气体中含有原子数为3NA | |
| B. | 1mol Na2O2和Na2O中离子总数均为2NA | |
| C. | 1mol Mg与足量O2或N2反应均失去2NA个电子 | |
| D. | 标准状况下22.4L H2含有NA个分子 |
9.下列叙述正确的是( )
| A. | O2分子间存在着非极性共价键 | |
| B. | CO2分子内存在着极性共价键 | |
| C. | SO2与H2O反应的产物是离子化合物 | |
| D. | 盐酸中含有H+和Cl-,故HCl为离子化合物 |
16.下列有关现在的长式元素周期表的判断中正确的是( )
| A. | 从左向右数第七纵行是ⅦA族 | |
| B. | 从左向右数第十一纵行是ⅠB族 | |
| C. | ⅠA族全部是金属元素 | |
| D. | 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
6.下列说法中正确的是( )
| A. | 非金属元素呈现的最高正化合价数值上等于该元素原子的最外层电子数 | |
| B. | 非金属元素呈现的最低负化合价,其绝对值等于该元素原子的最外层电子数 | |
| C. | 最外层有2个电子的原子都是金属原子 | |
| D. | 最外层有5个电子的原子都是非金属原子 |
13.下列叙述不正确的是( )
| A. | 工业上电解饱和食盐水的阳极反应为:2Cl--2e-═Cl2↑ | |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 铁表面镀锌,铁作阳极 |
10.下列物质属于纯净物的是( )
| A. | 食盐水 | B. | 干冰 | C. | 氯水 | D. | 浓硝酸 |
11.下列说法正确的是( )
| A. | 吸热反应一定是非自发的化学反应,放热反应不需要加热就能发生反应 | |
| B. | 其它条件不变时,增大压强可以增大活化分子百分数,使化学反应速率加快 | |
| C. | 温度、压强一定时,熵增加的反应都能自发进行 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |

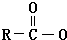 Na+NaOH$→_{△}^{CaO}$R-H+Na2CO3
Na+NaOH$→_{△}^{CaO}$R-H+Na2CO3 ,K的结构简式为
,K的结构简式为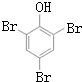 .
.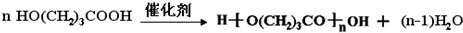 ;
;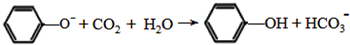 .
. (写结构简式).
(写结构简式).