题目内容
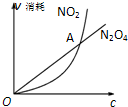 已知可逆反应:2NO2(g)N2O4(g)中,NO2、N2O4的消耗速率与其浓度存在如下关系:v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)(其中k1、k2是只与温度有关的常数),一定温度下根据上述关系式建立如图关系.下列说法正确的是( )
已知可逆反应:2NO2(g)N2O4(g)中,NO2、N2O4的消耗速率与其浓度存在如下关系:v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)(其中k1、k2是只与温度有关的常数),一定温度下根据上述关系式建立如图关系.下列说法正确的是( )| A、图中A点对应的状态表示该反应达到化学平衡 |
| B、若某温度时k1=k2,则该温度下反应的平衡常数K=0.5 |
| C、在1L密闭容器中充入1 mol NO2,平衡时:c(NO2)+c(N2O4)=1 mol?L-1 |
| D、在1L密闭容器中充入1 mol NO2,当c(NO2)=c(N2O4)时,NO2的转化率是33.3% |
考点:化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:A、图中,交点A表示消耗的速率v( N2O4)=v( NO2),该反应的所处的状态时,消耗的速率2v( N2O4)=v( NO2),所以此时,二氧化氮的消耗速率小于四氧化二氮的消耗速率,反应向正反应方向移动,据此判断;
B、由v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)结合k1=k2,求该温度下反应的平衡常数;
C、根据氮守恒c(NO2)+2c(N2O4)=1 mol?L-1;
D、用三行式求转化率.
B、由v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)结合k1=k2,求该温度下反应的平衡常数;
C、根据氮守恒c(NO2)+2c(N2O4)=1 mol?L-1;
D、用三行式求转化率.
解答:
解:A、图中,交点A表示的消耗速率v( N2O4)=v( NO2),而达到平衡时NO2的消耗速率应该是N2O4消耗速率的2倍,v( NO2)=2v( N2O4),因此此时v逆<v正,所以反应向正反应方向移动,故A错误;
B、由v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)结合k1=k2,可知
=
=
,所以
=0.5=K,故B正确;
C、根据氮守恒c(NO2)+2c(N2O4)=1 mol?L-1,故C错误;
D、2NO2(g)?N2O4(g)
初起1 mol 0
变化 2a a
平衡 a a
所以1-2a=a,则a=
,NO2的转化率是
×100%=66.6%,故D错误;故选B.
B、由v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)结合k1=k2,可知
| v(NO2) |
| v(N2O4) |
| k1?c2(NO2) |
| k2?c(N2O4) |
| 2 |
| 1 |
| c(N2O4) |
| c2(NO2) |
C、根据氮守恒c(NO2)+2c(N2O4)=1 mol?L-1,故C错误;
D、2NO2(g)?N2O4(g)
初起1 mol 0
变化 2a a
平衡 a a
所以1-2a=a,则a=
| 1 |
| 3 |
2×
| ||
| 1 |
点评:本题考查图象的分析,平衡状态的判断,化学平衡常数的计算,原子守恒,转化率的相关知识,综合性强,比较难.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 据报道,有一种叫Thibacillus Ferroxidans 的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐,发生的反应为:
据报道,有一种叫Thibacillus Ferroxidans 的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐,发生的反应为:
 如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).则滴管和烧瓶中所用试剂不可能是( )
如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).则滴管和烧瓶中所用试剂不可能是( )