题目内容
钒的用途十分广泛,有金属“维生素”之称.某工厂为了从含有杂质的VOSO4样品中回收得到催化剂V2O5,设计流程如下:
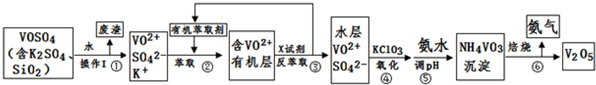
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式).NH4VO3在焙烧前要洗涤2-3次,该步操作方法为 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4 (水层)步骤②中萃取时必须加入适量碱,其原因是 .步骤③中X试剂为 .
(3)⑤的离子方程式为 .
(4)该工艺流程中,可以循环利用的物质有 和 .
(5)若取VOSO4样品wg,测得消耗a mol?L-1氯酸钾溶液VmL(氯酸钾还原产物为氯化钾),则1kg样品理论上可制得的V2O5质量是 g(用含w、V的代数式表示).

请回答下列问题:
(1)步骤①所得废渣的成分是
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4 (水层)步骤②中萃取时必须加入适量碱,其原因是
(3)⑤的离子方程式为
(4)该工艺流程中,可以循环利用的物质有
(5)若取VOSO4样品wg,测得消耗a mol?L-1氯酸钾溶液VmL(氯酸钾还原产物为氯化钾),则1kg样品理论上可制得的V2O5质量是
考点:金属的回收与环境、资源保护
专题:实验设计题
分析:(1)二氧化硅不与酸反应,过滤得到滤渣为二氧化硅;
(2)步骤②、③是萃取、分液,使用的主要仪器是分液漏斗;②中萃取时必须加入适量碱,会和平衡中的氢离子反应促进平衡正向进行;
(3)步骤⑤氨水与酸反应的离子方程式为:NH3?H2O+H+=NH4++H2O;
(4)分析流程图,物质参加反应,反应过程中又生成可以循环利用;
(5)根据方程式进行计算.
(2)步骤②、③是萃取、分液,使用的主要仪器是分液漏斗;②中萃取时必须加入适量碱,会和平衡中的氢离子反应促进平衡正向进行;
(3)步骤⑤氨水与酸反应的离子方程式为:NH3?H2O+H+=NH4++H2O;
(4)分析流程图,物质参加反应,反应过程中又生成可以循环利用;
(5)根据方程式进行计算.
解答:
解:(1)废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)酸溶后,V2O5、Fe2O3和酸反应,二氧化硅不与酸反应,过滤得到滤渣为二氧化硅;
故答案为:SiO2;在漏斗中加水至浸没沉淀,待水流尽后重复操作;
(2)②分析平衡,Rn+(水层)+nHA(有机层)?RAn(有机层)+nH+(水层),加入的碱会中和氢离子促进平衡正向进行,提高了钒的萃取率;
③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行;故答案为:加入的碱会中和氢离子促进平衡正向进行,提高了钒的萃取率;硫酸;
(3)步骤⑤氨水与酸反应的离子方程式为:NH3?H2O+H+=NH4++H2O,故答案为:NH3?H2O+H+=NH4++H2O;
(4)分析流程图,物质参加反应,反应过程中又生成的物质,或重复利用的物质可以循环利用,流程中有机萃取剂、氨气可以循环利用,
故答案为:氨气;有机萃取剂;
(5)根据电子守恒,n(VOSO4)×1=a mol?L-1×V×10-3L×6,则1kg样品理论上可制得的V2O5质量是
×
=
g;故答案为:
.
故答案为:SiO2;在漏斗中加水至浸没沉淀,待水流尽后重复操作;
(2)②分析平衡,Rn+(水层)+nHA(有机层)?RAn(有机层)+nH+(水层),加入的碱会中和氢离子促进平衡正向进行,提高了钒的萃取率;
③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行;故答案为:加入的碱会中和氢离子促进平衡正向进行,提高了钒的萃取率;硫酸;
(3)步骤⑤氨水与酸反应的离子方程式为:NH3?H2O+H+=NH4++H2O,故答案为:NH3?H2O+H+=NH4++H2O;
(4)分析流程图,物质参加反应,反应过程中又生成的物质,或重复利用的物质可以循环利用,流程中有机萃取剂、氨气可以循环利用,
故答案为:氨气;有机萃取剂;
(5)根据电子守恒,n(VOSO4)×1=a mol?L-1×V×10-3L×6,则1kg样品理论上可制得的V2O5质量是
| 6aV×10-3×163×1000g |
| wg |
| 182 |
| 326 |
| 546aV |
| w |
| 546aV |
| w |
点评:本题考查了流程分析判断,物质性质和实验设计的方法应用,题干信息分析判断能力,掌握基础是关键,题目难度中等.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
X、Y、Z、W是原子序数依次递增的四种短周期元素,甲、乙、丙、丁是它们两两组合而形成的化合物,且能发生反应:甲+乙→丙+丁,乙、丙、丁的化学式分别为Y2Z、YW2、ZX4,丁是一种常见的液体溶剂,0.1mol/L甲的水溶液的pH为1(25℃).下列说法正确的是( )
| A、原子半径:W>Z>Y>X |
| B、Z元素在周期表的位置为第三周期第ⅡA族 |
| C、丁的稳定性小于甲烷 |
| D、丙的水溶液呈碱性 |
自保定市被世界自然基金会选定为“中国低碳城市发展项目”的首批试点城市之后,“低碳”已经走进百姓生活、城市建设以及经济发展等各个领域,下列有关说法不正确的是( )
| A、太阳能、地热能、核能等均属于新能源 |
| B、“低碳”是指采用含碳量低的烃类化合物作燃料 |
C、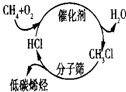 甲烷经一氯甲烷转化成低碳烯烃的途径体现了“节能减排”思想 |
| D、减少化石能源的使用能减少CO2的排放量 |
(A 做)将100mL2.0mol/L的Na2SO4和300mL2.0mol/L的AI2(SO4)3的溶液混合,则混合溶液中SO42-的物质的量浓度约为(假设溶液的体积可以相加)( )
| A、6.0g/mol |
| B、5.0g/mol |
| C、10.0g/mol |
| D、4.0g/mol |
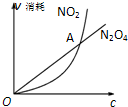 已知可逆反应:2NO2(g)N2O4(g)中,NO2、N2O4的消耗速率与其浓度存在如下关系:v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)(其中k1、k2是只与温度有关的常数),一定温度下根据上述关系式建立如图关系.下列说法正确的是( )
已知可逆反应:2NO2(g)N2O4(g)中,NO2、N2O4的消耗速率与其浓度存在如下关系:v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)(其中k1、k2是只与温度有关的常数),一定温度下根据上述关系式建立如图关系.下列说法正确的是( )| A、图中A点对应的状态表示该反应达到化学平衡 |
| B、若某温度时k1=k2,则该温度下反应的平衡常数K=0.5 |
| C、在1L密闭容器中充入1 mol NO2,平衡时:c(NO2)+c(N2O4)=1 mol?L-1 |
| D、在1L密闭容器中充入1 mol NO2,当c(NO2)=c(N2O4)时,NO2的转化率是33.3% |
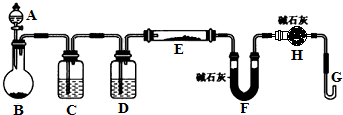 某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题:
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题: