题目内容
与水一样,甲醇也能微弱电离:2CH3OH(l)═CH3OH2++CH3O-,25℃时,K=2.0×10-17.若往一定量的甲醇中加入金属钠,则有关叙述正确的是( )
| A、金属钠与甲醇反应比金属钠与水反应更剧烈 |
| B、结合H+的能力CH3O->OH- |
| C、所得到溶液中K=c(CH3O-)×c(CH3OH2+) |
| D、所得到溶液中c(Na+)=c(CH3OH2+)+c(CH3O-) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.电离出来的氢离子浓度越大,与钠反应速率越大;
B.越难电离,则离子越易与氢离子结合;
C.K为甲醇中离子浓度的乘积;
D.根据电荷守恒分析.
B.越难电离,则离子越易与氢离子结合;
C.K为甲醇中离子浓度的乘积;
D.根据电荷守恒分析.
解答:
解:A.电离出来的氢离子浓度越大,与钠反应速率越大,水的电离程度大于甲醇,则水中氢离子浓度大,所以钠与水的反应比钠与甲醇反应更剧烈,故A错误;
B.越难电离,则离子越易与氢离子结合,甲醇难电离,则结合H+的能力CH3O->OH-,故B正确;
C.K为甲醇中离子浓度的乘积,则所得到溶液中K=c(CH3O-)×c(CH3OH2+),故C正确;
D.所得到溶液中存在电荷守恒,即c(Na+)+c(CH3OH2+)=c(CH3O-),故D错误.
故选BC.
B.越难电离,则离子越易与氢离子结合,甲醇难电离,则结合H+的能力CH3O->OH-,故B正确;
C.K为甲醇中离子浓度的乘积,则所得到溶液中K=c(CH3O-)×c(CH3OH2+),故C正确;
D.所得到溶液中存在电荷守恒,即c(Na+)+c(CH3OH2+)=c(CH3O-),故D错误.
故选BC.
点评:本题考查了甲醇的电离、平衡常数、电荷守恒的应用等,题目难度不大,注意甲醇的电离程度比水小.

练习册系列答案
相关题目
下列各组中的离子,能在溶液中大量共存的是( )
| A、Cu2+、Ba2+、C1-、SO42- |
| B、K+、Na+、OH-、C1- |
| C、Na+、H+、SO42-、OH- |
| D、H+、Na+、Cl-、CO32- |
甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )
| A、甲中水电离出来的H+ 的物质的量浓度是乙中水电离出来的H+ 的物质的量浓度的10倍 |
| B、中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)>V(乙) |
| C、物质的量浓度c(甲)>10c(乙) |
| D、甲中的c(OH-)为乙中的c(OH-)的10倍 |
炼铁的总反应为 Fe2O3(s)+3CO(g)→2Fe(s)+3CO2(g)+Q kJ,可能发生了以下过程:
3Fe2O3(s)+CO(g)→2Fe3O4(s)+CO2(g)+Q1 kJ;
Fe3O4(s)+CO(g)→3FeO(s)+CO2(g)+Q2 kJ;
FeO(s)+CO(g)→Fe(s)+CO2(g)+Q3 kJ.
则Q与Q1、Q2、Q2的关系式正确的是( )
3Fe2O3(s)+CO(g)→2Fe3O4(s)+CO2(g)+Q1 kJ;
Fe3O4(s)+CO(g)→3FeO(s)+CO2(g)+Q2 kJ;
FeO(s)+CO(g)→Fe(s)+CO2(g)+Q3 kJ.
则Q与Q1、Q2、Q2的关系式正确的是( )
| A、Q=Q1+Q2+Q3 | ||
| B、Q=Q1-Q2-Q3 | ||
C、Q=
| ||
D、Q=
|
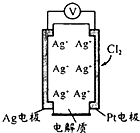 利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )
| A、电子经外电路流向Pt电极 |
| B、电池工作时,电解质中Ag+数目减少 |
| C、正极反应:C12+2e-+2Ag+=2AgCl |
| D、空气中c(C12)越大,Ag极消耗速率越快 |
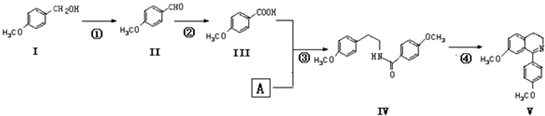
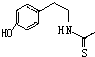 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为