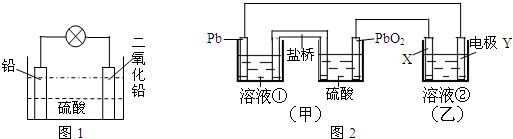
��Ŀ����
20��������A����·��ʯ����Ҫ�ɷ֣����ڽᾧˮ�������X•nH2O��ʾ����һ������������ͼ1��ʾ��ת����ϵ��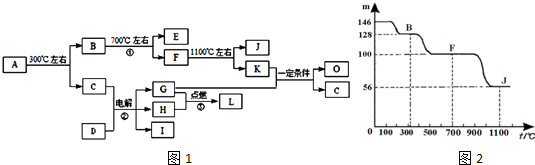
��֪��
�پ�������ͼ1�еĸ���ĸ���������ʾ��ɳ���Ԫ�أ�ԭ��������20����ɣ�����X������Ԫ����ɣ�����Ԫ�ص�ԭ�Ӹ���֮��Ϊ1��2��4����A��D���������������Ӹ����ȶ���1��1��D�е���������C��������ͬ�ĵ�������A�е���������D�е������ӵĵ��Ӳ�ṹ��ͬ��
��G��H�dz��������嵥�ʣ�E��K��L�dz��������廯���E�������������Ѫ�쵰��϶�ʹ���ж���K�Ĵ����ŷ�����ɵ�������ЧӦ��һ����Ҫԭ��
�۷�Ӧ�ڡ�������Ҫ�Ļ�����Ӧ��I��һ����Ҫ�Ļ���ԭ�ϣ�
��ͼ2�еIJ��ֱ仯�������ⶨ���õ���ͼ2��ʾ�Ĺ�����������m���¶�[t ���棩]�ı仯���ߣ��ش��������⣺
��1��д��A�Ļ�ѧʽ��CaC2O4•H2O��D�������ӵĽṹʾ��ͼΪ
 ��
����2����Ӧ�ٵĻ�ѧ����ʽΪ��CaC2O4$\frac{\underline{\;����\;}}{\;}$CaCO3+CO����
��3��K��G��һ�������¿����ɶ������ʣ��ȿɻ�þ���Ч�棬Ҳ���ٶԻ�������Ⱦ��
����O��һ���ӷ���Һ̬ȼ�ϣ��ж�������5-10mL�ᵼ��˫Ŀʧ������O�ķ���ʽΪ��CH4O��
����O��K��G��1��3�ı�����Ӧ���ã���O������B�������ţ�
A������ B��ϩ�� C��Ȳ�� D����������
���� ������A����·��ʯ����Ҫ�ɷ֣�����X•nH2O��ʾ����300���·ֽ�õ�B��C��B�������ȷֽ�õ���E���������룬��Ѫ�쵰��϶�ʹ���ж�����EΪCO��K�Ĵ����ŷ�����ɵ�������ЧӦ����Ҫԭ����KΪCO2����CΪH2O��D�е���������C��ˮ����������ͬ�ĵ�������D���������������Ӹ�������1��1�����D����Һ�õ���������G��H��I��Ӧ�ǵ��NaCl��Һ����DΪNaCl��G��H�ڵ�ȼ�����·�Ӧ����L����G��H�ֱ�Ϊ�����������е�һ�֣�LΪHCl��IΪNaOH��K��G��Ӧ�õ�O��C��ˮ������GΪH2��HΪCl2����4������O��һ���ӷ���Һ̬ȼ�ϣ��ж�������5��10mL�ᵼ��˫Ŀʧ������OΪCH3OH����O��K��G��1��3�ı�����Ӧ���ã���2CO2+6H2��C2H4+4H2O�����Կ��Եõ��л���������ϩ��
A�е���������D�е������ӵĵ��Ӳ�ṹ��ͬ����A��������ΪCa2+����X�к���Ca��C��OԪ�أ����X���е�����Ԫ�ص�ԭ�Ӹ���֮��Ϊ1��2��4����XΪCaC2O4��ͼ������100��87.7Ϊʧȥ�ᾧˮ�Ĺ��̣���$\frac{18n}{128+18n}$=1-87.7%�����n=1������ȷ��AΪCaC2O4•H2O����BΪCaC2O4��A����Է�������Ϊ146��F����Է�������Ϊ146��68.5%=100����FΪCaCO3��J����Է�������Ϊ146��38.4%=56����JΪCaO���ݴ˽��
��� �⣺������A����·��ʯ����Ҫ�ɷ֣�����X•nH2O��ʾ����300���·ֽ�õ�B��C��B�������ȷֽ�õ���E���������룬��Ѫ�쵰��϶�ʹ���ж�����EΪCO��K�Ĵ����ŷ�����ɵ�������ЧӦ����Ҫԭ����KΪCO2����CΪH2O��D�е���������C��ˮ����������ͬ�ĵ�������D���������������Ӹ�������1��1�����D����Һ�õ���������G��H��I��Ӧ�ǵ��NaCl��Һ����DΪNaCl��G��H�ڵ�ȼ�����·�Ӧ����L����G��H�ֱ�Ϊ�����������е�һ�֣�LΪHCl��IΪNaOH��K��G��Ӧ�õ�O��C��ˮ������GΪH2��HΪCl2����4������O��һ���ӷ���Һ̬ȼ�ϣ��ж�������5��10mL�ᵼ��˫Ŀʧ������OΪCH3OH����O��K��G��1��3�ı�����Ӧ���ã���2CO2+6H2��C2H4+4H2O�����Կ��Եõ��л���������ϩ��
A�е���������D�е������ӵĵ��Ӳ�ṹ��ͬ����A��������ΪCa2+����X�к���Ca��C��OԪ�أ����X���е�����Ԫ�ص�ԭ�Ӹ���֮��Ϊ1��2��4����XΪCaC2O4��ͼ������100��87.7Ϊʧȥ�ᾧˮ�Ĺ��̣���$\frac{18n}{128+18n}$=1-87.7%�����n=1������ȷ��AΪCaC2O4•H2O����BΪCaC2O4��A����Է�������Ϊ146��F����Է�������Ϊ146��68.5%=100����FΪCaCO3��J����Է�������Ϊ146��38.4%=56����JΪCaO���ݴ˽��
��1��������������֪��A�Ļ�ѧʽΪCaC2O4•H2O��DΪNaCl������������ΪCl-��Cl-���ӽṹʾ��ͼΪ ��
��
�ʴ�Ϊ��CaC2O4•H2O�� ��
��
��3����Ӧ�ٵĻ�ѧ����ʽΪ��CaC2O4$\frac{\underline{\;����\;}}{\;}$CaCO3+CO����
�ʴ�Ϊ��CaC2O4$\frac{\underline{\;����\;}}{\;}$CaCO3+CO����
��4������O��һ���ӷ���Һ̬ȼ�ϣ��ж�������5��10mL�ᵼ��˫Ŀʧ������OΪCH3OH��
�ʴ�Ϊ��CH4O��
����O��K��G��1��3�ı�����Ӧ���ã���2CO2+6H2��C2H4+4H2O�����Կ��Եõ��л���������ϩ��
��ѡ��B��
���� �����Կ�ͼ��ʽ���������ƶϣ��������ڲ²���֤���ƶϣ�����A�Ļ�ѧʽȷ��CΪˮ�Լ�E��K�����ʵ����ƶ�ͻ�ƿڣ�ע����������Ŀ��Ϣ����Ҫѧ����������Ԫ�ػ��������ʣ��ѶȽϴ�

 ��У����ϵ�д�
��У����ϵ�д� ���ڿ��淴ӦmA��s��+nB��g��?eC��g��+fD��g������Ӧ�����У���������������ʱC�İٷֺ������¶ȣ�T����ѹǿ��P����ϵ��ͼ��ʾ������������ȷ���ǣ�������
���ڿ��淴ӦmA��s��+nB��g��?eC��g��+fD��g������Ӧ�����У���������������ʱC�İٷֺ������¶ȣ�T����ѹǿ��P����ϵ��ͼ��ʾ������������ȷ���ǣ�������| A�� | ʹ�ô�����C�İٷֺ������� | |
| B�� | ���£���ѧƽ��������Ӧ�����ƶ� | |
| C�� | ��ѧ����ʽ�Ļ�ѧ��������ϵm+n��e+f | |
| D�� | �÷�Ӧ��һ�����ȷ�Ӧ |
| A�� | ��֪������0.1 mol��L -1NaCN��Һ��pH=12������ˮ���CN -Լռ������10% | |
| B�� | ��֪25��ʱNH4CN��Һ�Լ��ԣ���25��ʱ�ĵ��볣��K��NH 3��H 2O����K��HCN�� | |
| C�� | NH4ClO4��Һ�У�c��ClO4-����c ��NH4+����c��OH -����?c��H +��? | |
| D�� | ��ʹ0.1 mol•L-1Na2S��Һ��$\frac{c��Na��^{+}}{c��{S}^{2-}��}$���ӽ�2���ɼ�������KOH |
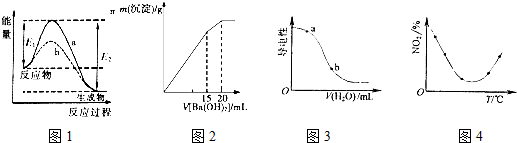
| A�� | ͼ1��ʾij���ȷ�Ӧ��������a�����д�����b��ʱ��Ӧ�������仯���Ҽ�������ı䷴Ӧ���ʱ� | |
| B�� | ͼ2��ʾij������Һ�м���Ba��OH��2��Һ�����������������Ba��OH��2��Һ����Ĺ�ϵ���ڼ���20 mL Ba��OH��2��Һʱ������ǡ�ó�����ȫ | |
| C�� | ͼ3��ʾ��CH3COOH��Һ�м�ˮʱ��Һ�ĵ����Ա仯����CH3COOH��Һ��pH��a��b | |
| D�� | ͼ4��ʾ����NO2���ݻ���ͬ�ĺ����ܱ������У���ͬ�¶��·ֱ�����Ӧ��2NO2��g��?N2O4��g������ͬʱ�����NO2���������ߣ���÷�Ӧ�ġ�H��0 |
| A�� | pH=2�Ĵ�����Һ��pH=12��NaOH��Һ�������ϣ�c��Na+��+c��H+��=c��OH-��+c��CH3COO-�� | |
| B�� | Na2CO3��Һ�У�2c��Na+��=c��CO${\;}_{3}^{2-}$��+c��HCO${\;}_{3}^{-}$��+c��H2CO3�� | |
| C�� | NaHCO3��Һ�У�c��H+��+c��H2CO3��=c��OH-��+c��CO${\;}_{3}^{2-}$�� | |
| D�� | �����£�pH=4.75��Ũ�Ⱦ�Ϊ0.1mol•L-1��CH3COOH��CH3OONa���Һ��c��CH3COO-��+c��OH-����c��CH3COOH��+c��H+�� |
| A�� | �����ӵİ뾶��С��ϵ��B��C��E | |
| B�� | D��E����Ԫ���γɵĻ�������ܺ������Ӽ����ۼ� | |
| C�� | B��D�ֱ��C�γɵĻ�������п���ʹ��ˮ��Ʒ����Һ��ɫ | |
| D�� | A��B��C����Ԫ���γɵĻ������������һ����ͬ |