题目内容
13.有人设计将两根铂丝做电极插入到KOH溶液中,然后在两极上分别通入甲烷和氧气而构成燃料电池.该电池中反应的化学方程式为CH4+2O2+2KOH═K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是 (已知1个电子所带电量为1.6×10-19C)( )| A. | 通入甲烷的电极为电池的负极,通入氧气的电极为正极 | |
| B. | 在标准状况下,每消耗5.6 L O2,可向外提供2.4×104 C的电量 | |
| C. | 通入甲烷电极的电极反应为:CH4+10OH--8e-═CO32-+7H2O | |
| D. | 放电一段时间后,溶液的pH减小 |
分析 甲烷碱性燃料电池工作时,正极发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,甲烷在负极发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,结合电极方程式以及题目要求可解答该题.
解答 解:A.根据原电池总反应式可知甲烷被氧化,应为原电池的负极反应,氧气得电子被还原,应为原电池的正极反应,故A正确;
B.n(O2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,转移电子的物质的量为0.25mol×4=1mol,则可向外提供9.6×104C的电量,故B错误;
C.碱性条件下,甲烷在负极发生氧化反应生成碳酸根离子,则甲烷电极的电极反应为CH4+10OH--8e-=CO32-+7H2O,故C正确;
D.根据总方程式可知反应消耗KOH,OH-浓度减小,则pH减小,故D正确.
故选B.
点评 本题考查了燃料电池知识,燃料电池电极反应式的书写要注意结合电解质溶液书写,原料相同,电解质溶液不同,电极反应式不同,如氢氧燃料电池,电解质为酸或碱时,电极反应式就不同,题目难度中等.

练习册系列答案
相关题目
3.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 某无色溶液:CO32-NO3- Al3+ Ba2+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 加入Al能放出H2的溶液中 NH4+、Cl-、Na+、SO42- | |
| D. | 酸性溶液中:NO3-、SO32-、Na+、Fe3+ |
1.纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体.下列区分这种两种物质的方法正确的是( )
| A. | 分别用炒锅加热两种样品,全部分解挥发,没有物质残留的是小苏打 | |
| B. | 先将两样品配成溶液,分别加入CaCl2,无白色沉淀生成的是小苏打 | |
| C. | 两只小玻璃杯,分别加入少量两种样品,再加入等浓度等体积的食醋,产生气泡快的是小苏打 | |
| D. | 先将两样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打 |
8.将一定量的CO2溶于100mL的0.4mol•L-1 KOH溶液.CO2被完全吸收,得到K2CO3和KHCO3的混合溶液.向所得溶液中逐滴加入0.2mol•L-1盐酸,至逸出的CO2与原先吸收的CO2质量相等.此时消耗的盐酸的体积为( )
| A. | 100 mL | B. | 200 mL | C. | 300 mL | D. | 400 mL |
18.下列事实中,能用同一化学原理解释的是( )
| A. | 氯气和二氧化硫都能使品红溶液褪色 | |
| B. | 异戊烷和异戊二烯都能使溴水层褪色 | |
| C. | 亚硫酸钠和乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 活性炭与氢氧化钠溶液都能使二氧化氮气体褪色 |
5.硫酸锰可用于饲料营养强氧化剂和媒染剂.其生产原材料软锰矿(MnO2)、菱锰矿(MnCO3)中常混有硫酸亚铁和硫酸镁等杂质,生产工艺如图1:
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如图2.(2)完全沉淀离子的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为l1.6.
下列判断正确的是( )
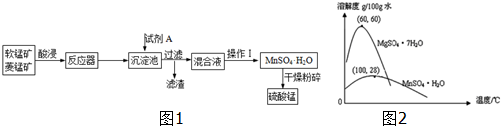
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如图2.(2)完全沉淀离子的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为l1.6.
下列判断正确的是( )

| A. | 试剂A应该选择H2O2,目的是将Fe2+氧化为Fe3+ | |
| B. | 试剂A应该选择氨水,目的是调节溶液的pH | |
| C. | 操作I包括蒸发、冷却、结晶、趁热过滤、洗涤、等步骤,洗涤时可用稀硫酸做洗液 | |
| D. | 在蒸发结晶时,温度应该高于60°C |
3.漂白粉的主要成分是( )
| A. | 次氯酸钙 | B. | 氯化钙 | ||
| C. | 次氯酸 | D. | 次氯酸钙与氯化钙 |
 命名为:3,3-二甲基-1-戊烯;写出该物质与HBr反应的化学方程式:CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3
命名为:3,3-二甲基-1-戊烯;写出该物质与HBr反应的化学方程式:CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3
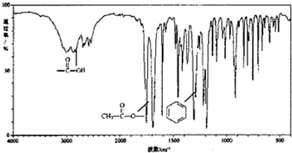 有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图:
有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图: .
.