题目内容
相同条件下,分别向等体积、pH=2的盐酸、硫酸、醋酸溶液中加入足量的Zn充分反应后产生H2的量是( )
| A、盐酸中放出的H2最多 |
| B、硫酸中放出的H2最多 |
| C、醋酸中放出的H2最多 |
| D、三种酸中产生的H2一样多 |
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:相同条件下,相同pH的不同酸分别与足量锌反应生成氢气的量与酸最终电离出氢离子的物质的量成正比,据此分析解答.
解答:
解:相同条件下,pH=2的硫酸、盐酸和醋酸,体积相等时,醋酸浓度最大,最终电离出氢离子物质的量大小顺序是:醋酸>盐酸=硫酸,分别与足量锌反应时生成氢气的量与酸的物质的量成正比,所以充分反应后生成氢气的量大小顺序为:醋酸>硫酸=盐酸,故选C.
点评:本题考查了弱电解质的电离,明确不同的酸与金属反应生成氢气的量与最终电离出n(H+)成正比,与电解质强弱无关,为易错点.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
精制食盐水时下列物质中,不必用到的有( )
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液.
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液.
| A、③④⑤ | B、③⑤⑦ |
| C、②⑤⑥ | D、②④⑤⑦ |
既与稀HCl反应,又与NaOH溶液反应的是( )
| A、Mg | B、Al | C、Fe | D、Cu |
关于焰色反应的叙述正确的是( )
| A、所有金属及其化合物在灼烧时都呈特征颜色 |
| B、进行焰色实验的铂丝用稀硫酸洗净后再蘸取样品灼烧 |
| C、透过蓝色钴玻璃观察钾元素的焰色是为了滤去黄光干扰 |
| D、金属钠在空气中燃烧发出黄光不是钠元素的焰色所致 |
下列有机物的命名正确的是( )
| A、3,4,4-三甲基己烷 |
| B、二氯乙烷 |
| C、2,2-二甲基-3-戊烯 |
| D、4-甲基-2-戊炔 |
强酸和强碱稀溶液的中和热可表示为( )
H+(aq)+OH-(aq)=H2O(l),△H=-57.3kJ/mol
①HCl(aq)+NH3?H2O(aq)=NH4Cl(aq)+H2O(l),△H=-akJ/mol
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l),△H=-bkJ/mol
③Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l),△H=-ckJ/mol
则a,b,c三者的大小关系判断错误的是( )
H+(aq)+OH-(aq)=H2O(l),△H=-57.3kJ/mol
①HCl(aq)+NH3?H2O(aq)=NH4Cl(aq)+H2O(l),△H=-akJ/mol
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l),△H=-bkJ/mol
③Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l),△H=-ckJ/mol
则a,b,c三者的大小关系判断错误的是( )
| A、c>114.6 |
| B、a<57.3 |
| C、b>57.3 |
| D、2a=2b=c |
 表代表周期表中的几种短周期元素,下列说法中错误的是( )
表代表周期表中的几种短周期元素,下列说法中错误的是( )| A、C、D气态氢化物稳定性强弱和沸点高低均为C>D |
| B、A、B、C第一电离能的大小顺序为C>B>A |
| C、AD3和ED4两分子的中心原子均为sp3杂化 |
| D、ED4分子中各原子均达8电子结构 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、1molNa2O2晶体中含有的离子总数为4NA |
| B、常温下,100mLlm/LNa2CO3溶液中阴离子总数大于0.1NA |
| C、假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶粒微粒数为NA |
| D、标准状况下,0.1molCl2溶于水,转移的电子数为0.1NA |
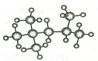 按系统命名法命名为:
按系统命名法命名为: