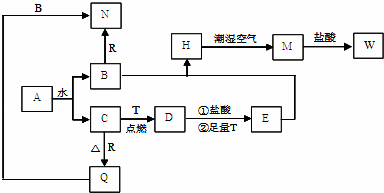
题目内容
17.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,甲烷不能使酸性高锰酸钾溶液褪色 | |
| C. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| D. | 苯酚能与溴水反应,而苯不能与溴水反应 |
分析 A、苯环对酚羟基影响的结果是酚羟基具有酸性;
B、甲基连接在苯环上,可被氧化;
C、根据C=C官能团的性质分析;
D、苯酚与溴水常温可以反应,而苯与溴水不能反应,可说明羟基对苯环有影响;
解答 解:A、在苯酚中,由于苯环对-OH的影响,酚羟基具有酸性,对比乙醇,虽含有-OH,但不具有酸性,能说明上述观点,故A错误;
B、甲基连接在苯环上,可被氧化,说明苯环对甲基影响,故B错误;
C、乙烯和乙烷结构不同,乙烯含有C=C,可发生加成反应,不能用上述观点证明,故C正确;
D、苯酚和苯都含有苯环,但苯酚含有羟基,苯酚与溴水常温可以反应,而苯与溴水不能反应,可说明羟基对苯环有影响,故D错误;
故选C.
点评 本题考查有机物的结构和性质,题目难度不大,注意有机物的原子团之间相互影响的特点.

练习册系列答案
相关题目
7.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )
| A. | 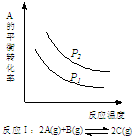 反应:△H>0,P2>P1 | B. | 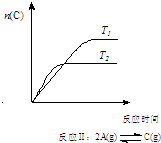 反应:△H<0,T1<T2 | ||
| C. | 反应:△H>0,T2>T1;或△H<0,T2<T1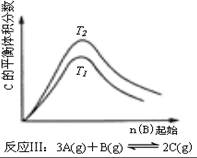 | D. | 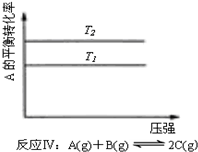 反应:△H<0,T2>T1 |
5.某有机物的蒸气完全燃烧时需要3倍于其体积的氧气,产生2倍于其体积的CO2,该有机物可能是( )
| A. | CH3CH3 | B. | CH3CH2OH | C. | CH3CHO | D. | CH3COOH |
9.下列关于硝酸的认识中,正确的是( )
| A. | 浓硝酸和稀硝酸都具有氧化性 | |
| B. | 浓硝酸与金属反应不产生氢气,而稀硝酸与金属反应可置换出氢气 | |
| C. | 因常温下铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中 | |
| D. | 硝酸与金属反应时,只表现出氧化性 |
6.常温常压下为无色液体,而且密度大于水的是( )
| A. | 乙醇 | B. | 一氯甲烷 | C. | 溴苯 | D. | 乙酸乙酯 |
7.下列操作不能达到目的是( )
| 选项 | 目的 | 操作 |
| A | 配制100mL1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| B | 除去固体Na2CO3中的少量NaHCO3 | 将混合物加热充分反应 |
| C | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中通入SO2气体至紫色消失 |
| 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A. | A | B. | B | C. | C | D. | D |
 已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族.
已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族. (1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2×10-7mol/Lmol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11mol/Lmol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2×10-7mol/Lmol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11mol/Lmol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).