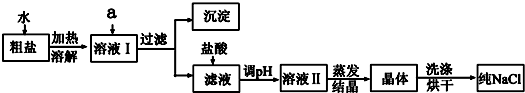
题目内容
17.C、N、O、Si、S、Cl等元素形成的单质中①属于空气主要成分它们相互反应的化学方程式N2+O2$\frac{\underline{\;高温\;}}{\;}$2NO;
②常用于自来水消毒的是实验室制备该气体的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O.
分析 ①空气中氮气和氢气在高温下反应生成NO;
②常用于自来水消毒的是氯气,实验室用二氧化锰和浓盐酸加热制取氯气.
解答 解:①空气中氮气和氢气在高温下反应生成NO,反应方程式为N2+O2$\frac{\underline{\;高温\;}}{\;}$2NO,故答案为:N2+O2$\frac{\underline{\;高温\;}}{\;}$2NO;
②常用于自来水消毒的是氯气,实验室用二氧化锰和浓盐酸加热制取氯气,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O.
点评 本题考查化学反应方程式的书写,根据反应物、生成物及反应条件书写方程式即可,注意基础知识的积累和掌握,注意浓盐酸和二氧化锰在加热条件下反应,但稀盐酸和二氧化锰在加热条件下不反应.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
7.下列说法正确的是( )
| A. | 在所有元素中,氟的第一电离能最大 | |
| B. | 氨气的水溶性大于甲烷的水溶性,原因是氨气分子之间能形成氢键 | |
| C. | 元素的金属性越强,其电负性一定越小 | |
| D. | 根据金属元素的逐级电离能数据可大致推断出此元素的最高化合价 |
8.下列实验操作中有错误的是( )
| A. | 、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 在分液漏斗中进行萃取操作时应该边振荡边放气 | |
| C. | 蒸馏操作时,使用的冷凝水应该由低往高流,形成逆流 | |
| D. | 过滤时,用玻璃棒轻轻搅拌以加速过滤 |
5.下列各项除杂所用方法正确的是( )
| A. | KCl固体混有KClO3:加少量二氧化锰固体并加热 | |
| B. | CO2中混有CO气体:通入氧气中点燃 | |
| C. | 硝酸钾溶液中混有氯化钠:加入四氯化碳萃取并分液 | |
| D. | Cu(NO3)2溶液混有AgNO3:加入过量的铜粉并过滤 |
12. 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2 (用K1、K2表示),
△H3═△H1+△H2 (用△H1、△H2表示);根据反应③判断△S<0(填“>”、“=”或“<”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有ADF(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.降低温度 E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.3mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正<v逆(填“>”、“=”或“<”).
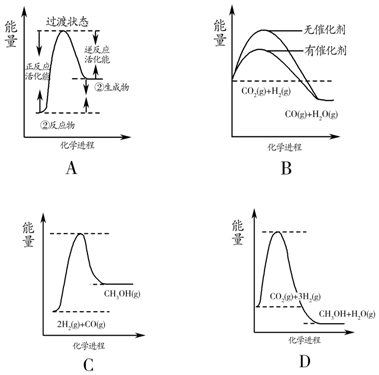
(5)根据表格测得焓变,下列能量关系图合理的是AD.
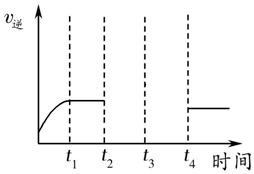
(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2 (用K1、K2表示),
△H3═△H1+△H2 (用△H1、△H2表示);根据反应③判断△S<0(填“>”、“=”或“<”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有ADF(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.降低温度 E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.3mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正<v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是AD.

(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
2.有一瓶澄清溶液,其中可能含有可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-.取该溶液进行以下实验:
(1)填写表中开空白:
(2)根据以上事实,该溶液中肯定存在的离子是Ba2+、I-、NH4+.
(1)填写表中开空白:
| 实验步骤 | 肯定不存在的离子 |
| ①用PH试纸检验,溶液呈强酸性 | |
| ②取出部分溶液,加入少量CCl4和数滴新制氯水,振荡,精置CCl4层呈紫红色 | |
| ③另取出部分溶液,向其加入NaOH溶液,使溶液从酸性变为碱性,在滴加过程中及滴加完毕后,均无沉淀产生 | |
| ④取③中的部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝 | |
| ⑤另取③中的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成 |
6.下列离子方程式书写正确的是( )
| A. | 碳酸钙中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸钠溶液中加入氢氧化铜:Cu2++CO32-═CuCO3↓ | |
| D. | 澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |