题目内容
如图所示,关于该装置的下列叙述中,不正确的是( )
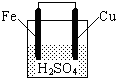

| A、铁棒是负极,发生氧化反应 |
| B、铜棒上有气体放出 |
| C、稀硫酸的pH值不断减小 |
| D、电池总反应方程式可表示为:Fe+2H+=Fe2++H2↑ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:Fe比铜Cu活泼,形成原电池反应时,Fe为负极,Cu为正极,负极发生氧化反应,正极发生还原反应,以此解答该题.
解答:
解:A.铁比铜活泼,为原电池的负极,发生氧化反应,故A正确;
B.铜为正极,电极方程式为2H++e-=H2↑,故B正确;
C.反应消耗H+,溶液pH增大,故C错误;
D.电池总反应为铁置换出氢气的反应,总方程式可表示为:Fe+2H+=Fe2++H2↑,故D正确.
故选C.
B.铜为正极,电极方程式为2H++e-=H2↑,故B正确;
C.反应消耗H+,溶液pH增大,故C错误;
D.电池总反应为铁置换出氢气的反应,总方程式可表示为:Fe+2H+=Fe2++H2↑,故D正确.
故选C.
点评:本题考查原电池知识,为高频考点,侧重于基本理论知识的综合理解和运用的考查,注意把握原电池的工作原理,难度不大.

练习册系列答案
相关题目
以NA表示阿伏伽德罗常数的数值,下列说法不正确的是( )
| A、1 L1 mol/L H2SO4,含有2NA个H+ |
| B、500 mL 2 mol/L盐酸比100 mL 2 mol/L硫酸的导电性强 |
| C、1 mol Na2S2,含NA个共价键 |
| D、标准状况下,3.36 LSO2的质量约为9.6g |
氢氧燃料电池已用于航天飞机.关于原电池的叙述正确的是( )
| A、将光能转化为动能 |
| B、将热能转化为机械能 |
| C、将化学能转化为电能 |
| D、燃料电池的能量转化率可达100% |
已知强酸和强碱在稀溶液中发生中和反应生成1molH2O(l)时放出57.30kJ热量,用500mL0.60mol/L
H2SO4溶液与200mL5mol/LNaOH溶液完全反应,放出的热量是( )
H2SO4溶液与200mL5mol/LNaOH溶液完全反应,放出的热量是( )
| A、68.76kJ |
| B、57.30 kJ |
| C、34.38kJ |
| D、17.19 kJ |
下列溶液具有漂白性的是( )
| A、新制氯水 | B、氨水 |
| C、石灰水 | D、苏打水 |
分子式为C6H12的烯烃与H2O的加成产物,不能发生催化氧化反应的有(不考虑立体异构)( )
| A、3种 | B、4种 | C、5种 | D、6种 |
利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
A、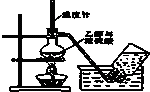 验室制取乙烯 |
B、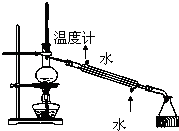 石油的分馏实验 |
C、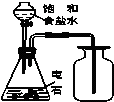 实验室制取乙炔并收集 |
D、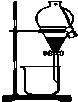 利用酒精萃取碘水中的I2单质 |