题目内容
以NA表示阿伏伽德罗常数的数值,下列说法不正确的是( )
| A、1 L1 mol/L H2SO4,含有2NA个H+ |
| B、500 mL 2 mol/L盐酸比100 mL 2 mol/L硫酸的导电性强 |
| C、1 mol Na2S2,含NA个共价键 |
| D、标准状况下,3.36 LSO2的质量约为9.6g |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.根据n=cV计算出硫酸的物质的量,再计算出氢离子的物质的量及数目;
B.溶液的导电性与溶液中离子浓度大小有关,根据溶液中离子浓度大小判断两溶液中导电性强弱;
C.1 mol Na2S2中含有1molS-S共价键;
D.根据n=
计算出二氧化硫的物质的量,再根据m=nM计算出二氧化硫的质量.
B.溶液的导电性与溶液中离子浓度大小有关,根据溶液中离子浓度大小判断两溶液中导电性强弱;
C.1 mol Na2S2中含有1molS-S共价键;
D.根据n=
| V |
| 22.4L/mol |
解答:
解:A.1L1 mol/L H2SO4中含有1mol溶质硫酸,含有2mol氢离子,含有2NA个H+,故A正确;
B.2 mol/L盐酸中含有氯离子和氢离子浓度都是2mol/L,而2 mol/L硫酸溶液中含有含有氢离子浓度为4mol/L,含有硫酸根离子浓度为2mol/L,所以盐酸溶液导电性比硫酸溶液的导电性差,故B错误;
C.1 mol Na2S2中含有1molS-S共价键,含NA个共价键,故C正确;
D.标况下,3.36L二氧化硫的物质的量为:
=0.15mol,0.15mol二氧化硫的质量为:64g/mol×0.15mol=9.6g,故D正确;
故选B.
B.2 mol/L盐酸中含有氯离子和氢离子浓度都是2mol/L,而2 mol/L硫酸溶液中含有含有氢离子浓度为4mol/L,含有硫酸根离子浓度为2mol/L,所以盐酸溶液导电性比硫酸溶液的导电性差,故B错误;
C.1 mol Na2S2中含有1molS-S共价键,含NA个共价键,故C正确;
D.标况下,3.36L二氧化硫的物质的量为:
| 3.36L |
| 22.4L/mol |
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意溶液导电性与溶质的物质的量无关,与溶液中各离子的浓度有关,要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
下列关于实验原理或操作的叙述中,不正确的是( )
| A、从碘水中提取单质碘时,不能用酒精代替CCl4 |
| B、除去HNO3溶液中的H2SO4溶液:加适量BaCl2溶液后过滤 |
| C、除去KNO3晶体中的NaCl:用蒸馏水溶解后,蒸发浓缩,降温结晶,过滤 |
| D、除去Cu粉中混有的CuO:加适量稀盐酸后,过滤、洗涤、干燥 |
科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性.“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似.下列说法不正确的是( )
| A、“钴酞菁”分子所形成的分散系具有丁达尔效应 |
| B、此项工作可以用来改变分子的某些物理性质 |
| C、此工作可广泛应用于光电器件、生物技术等方面 |
| D、在分散系中,“钴酞菁”分子直径比Na+的直径小 |
某实验需2mol/L的Na2CO3溶液950mL,为此配制该溶液时应选用的容量瓶规格和需称取Na2CO3的质量分别是( )
| A、950 mL、201.4 g |
| B、1000 mL、212 g |
| C、任意规格、201.4 g |
| D、1000 mL、201.4 g |
下列叙述中正确的是( )
(1)纯铁比碳素钢易生锈(2)用氨水除去试管上的银镜
(3)硅是制作光导纤维和制造太阳能电池的主要原料
(4)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性Cl>C(碳)>Si
(5)催化剂只能改变反应的活化能,不能改变反应的热效应
(6)用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
(7)同主族元素的简单阴离子还原性越强,水解程度越大
(8)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝
(9)丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
(10)明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视
(11)用浸泡过的高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
(12)同周期金属元素的化合价越高,其原子失电子能力越弱.
(1)纯铁比碳素钢易生锈(2)用氨水除去试管上的银镜
(3)硅是制作光导纤维和制造太阳能电池的主要原料
(4)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性Cl>C(碳)>Si
(5)催化剂只能改变反应的活化能,不能改变反应的热效应
(6)用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
(7)同主族元素的简单阴离子还原性越强,水解程度越大
(8)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝
(9)丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
(10)明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视
(11)用浸泡过的高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
(12)同周期金属元素的化合价越高,其原子失电子能力越弱.
| A、(1)(4)(5)(6)(7)(11)(12) |
| B、(2)(3)(5)(7)(9)(12) |
| C、(1)(3)(4)(5)(6)(11) |
| D、(5)(6)(8)(9)(11)(12) |
“保护环境,就是保护人类自己”.下列环境问题与产生的主要原因不相符的是( )
| A、“臭氧空洞”主要是大量使用氟氯代烃等引起的 |
| B、“酸雨”主要是由空气中CO2浓度增大引起的 |
| C、“白色污染”主要是由聚乙烯塑料等引起的 |
| D、“赤潮”主要是由水体中P、N等元素过量引起的 |
把物质的量浓度均为0.1mol?L-1的HA和B OH溶液等体积混合,下列说法错误的是( )
| A、若HA为弱酸,BOH为弱碱,则有C(H+)+C(B+)═C(OH-)+C(A-) |
| B、若HA为强酸,BOH为弱碱,则有C(A-)>C(B+)>C(H+)>C(OH-) |
| C、若HA为弱酸,BOH为强碱,则有C(B+)>C(A-)>C(OH-)>C(H+) |
| D、若HA为强酸,BOH为强碱,则有C(H+)=C(A-)=C(B+)=C(OH-)=0.1mol?L-1 |
如图所示,关于该装置的下列叙述中,不正确的是( )
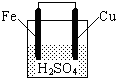

| A、铁棒是负极,发生氧化反应 |
| B、铜棒上有气体放出 |
| C、稀硫酸的pH值不断减小 |
| D、电池总反应方程式可表示为:Fe+2H+=Fe2++H2↑ |