题目内容
15.磷酸铁锂电池是一种新型锂电池,该电池的总反应式为Li+FePO4═LiFePO4.该电池所用的磷酸亚铁锂可按如下方法生产:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中灼烧即得晶态磷酸亚铁锂,下列有关说法错误的是( )| A. | 在电解制备磷酸亚铁锂的过程中,阳极的电极反应式为:Fe+H2PO4-+Li+-2e-═LiFePO4+2H+ | |
| B. | 放电过程中Li+向负极移动,充电过程中Li+向阴极移动 | |
| C. | 充电时,LiFePO4既发生氧化反应又发生还原反应 | |
| D. | 该锂电池放电时正极反应式为FePO4+Li++e-═LiFePO4 |
分析 A、铁棒为阳极,本身放电;
B、原电池中阳离子向正极移动,电解池中阳离子向阴极移动;
C、充电时,总的电极反应式为:LiFePO4═Li+FePO4,Fe的化合价升高,而锂的化合价降低;
D、正极发生还原反应;
解答 解:A、铁棒为阳极,本身放电,所以电极反应式为:Fe+H2PO4-+Li+-2e-═LiFePO4+2H+,故A正确;
B、原电池中阳离子向正极移动,电解池中阳离子向阴极移动,所以放电过程中Li+向正极移动,充电过程中Li+向阴极移动,故B错误;
C、充电时,总的电极反应式为:LiFePO4═Li+FePO4,Fe的化合价升高,而锂的化合价降低,所以LiFePO4既发生氧化反应又发生还原反应,故C正确;
D、正极发生还原反应,所以电极反应式为:FePO4+Li++e-═LiFePO4,故D正确;
故选B.
点评 本题考查了电解原理,选项C根据电极反应式中元素化合价变化确定反应的类型,题目难度不大.

练习册系列答案
相关题目
10.下列各组说法均不正确的是( )
①CH3-CH=CH2和CH2=CH2的最简式相同
②丁二烯和丁烯为同系物
③标准状况下,11.2L的己烷所含的分子数为0.5NA (NA为阿伏加德罗常数)
④CH≡CH和C6H6含碳量相同
⑤正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法.
①CH3-CH=CH2和CH2=CH2的最简式相同
②丁二烯和丁烯为同系物
③标准状况下,11.2L的己烷所含的分子数为0.5NA (NA为阿伏加德罗常数)
④CH≡CH和C6H6含碳量相同
⑤正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法.
| A. | ①②⑥ | B. | ②③④ | C. | ②③⑥ | D. | ④⑤⑥ |
20.下列物质中,不属于卤代烃的是( )
| A. | 硝基苯 | B. | 溴苯 | C. | 四氯化碳 | D. | 氯乙烯 |
7.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 6.4g 铜与S完全反应,电子转移0.1 NA个 | |
| B. | 标准状况下,2.24 L水中含有0.1 NA个水分子 | |
| C. | 1.12 L氯气中含有0.1 NA个氯原子 | |
| D. | 0.3molNO2与H2O反应转移的电子数为0.1NA |
4.下列实验方案正确的是( )
| A. | 利用与氢气的加成反应除去乙烷中的乙烯得到纯净的乙烷 | |
| B. | 利用溴水鉴别苯和甲苯 | |
| C. | 利用酸性高锰酸钾溶液鉴别乙苯和苯乙烯 | |
| D. | 利用四氯化碳萃取溴水中的溴 |
5.下列分子或离子中,中心原子含有孤对电子的是( )
| A. | NH4+ | B. | CCl4 | C. | SiH4 | D. | PH3 |
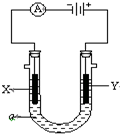 电解原理在化学工业中有广泛应用.
电解原理在化学工业中有广泛应用. ②Cl2
②Cl2 ③CO2
③CO2 ④H2O2
④H2O2 ⑤HClO
⑤HClO ⑥HCN
⑥HCN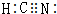
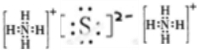 ⑧Ca(OH)2
⑧Ca(OH)2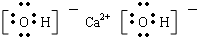 ⑨N2H4
⑨N2H4 ⑩CO(NH2)2
⑩CO(NH2)2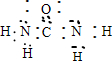 .
.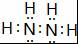 ;
;