题目内容
18.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol?L-1、0.001mol?L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol?L-1)的用量均为2mL.(1)该反应的离子方程式为5H2C2O4十2MnO4-十6H+=2Mn2+十10CO2↑十8H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ | 0 |
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是反应生成的锰离子起了催化作用
若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是B
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?
不可行(填可行或不可行)若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应
③还有一组同学改变KMnO4酸性溶液的浓度,做了下表中实验
| 实验编号 | 20℃下,试管中所加试剂及其用量/mL | 20℃下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | V2 | 6.4 |
分析 (1)据氧化还原反应中得失电子相等和原子守恒书写离子方程式;
(2)根据实验的目的和影响化学反应速率的因素来设计实验;
(3)影响化学反应速率的因素有温度、浓度、压强、催化剂和接触面积,据此结合该反应特点进行分析;
(4)①先求出反应开始时c(KMnO4),然后求出三次褪色的平均时间,最后根据ν(KMnO4)=$\frac{△c}{△t}$进行计算;
②因颜色是由KMnO4产生,虽然KMnO4浓度大反应快,但KMnO4的量也多,故无法比较;如想通过直接观察褪色时间长短来判断必须保证高锰酸钾的体积与浓度相同,草酸过量;
③只改变KMnO4酸性溶液的浓度,硫酸的用量相同,都是2.0mL,通过加蒸馏水使溶液总体积不变.
解答 解:(1)草酸使酸性高锰酸钾褪色,是+7价的Mn氧化了草酸根,Mn变为+2价,C变为+4价,生成二氧化碳,据氧化还原反应中得失电子相等和原子守恒书写离子方程式为:5H2C2O4十2MnO4-十6H+=2Mn2+十10CO2↑十8H2O,
故答案为:5H2C2O4十2MnO4-十6H+=2Mn2+十10CO2↑十8H2O;
(2)由实验目的可知,探究浓度、温度、接触面积对化学反应速率的影响,
实验①和②探究KMnO4酸性溶液的浓度对反应速率的影响,则实验①②的温度、催化剂的用量相同,只有浓度不同;实验①③的温度不同,则实验目的是探究温度对化学反应速率的影响,则①③中只有温度不同,其他条件相同;实验①④应该是探究催化剂对反应速率的影响,则①④中只有催化剂的用量不同,其他条件相同,据此完成表格为:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | 298 | 0.5 | 0.001 | |
| ③ | 323 | 0.5 | 0.01 | |
| ④ | 298 | 0 | 0.01 |
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | 298 | 0.5 | 0.001 | |
| ③ | 323 | 0.5 | 0.01 | |
| ④ | 298 | 0 | 0.01 |
(3)开始缓慢褪色,后来迅速变成无色,说明反应速率明显加快,排除温度的影响,反应过程中浓度减小,在溶液中进行压强无影响,只能是生成物对反应有催化作用,分析生成物可知,其他离子原溶液中有,只能是锰离子起了催化作用;为了证明猜想,除酸性高锰酸钾、草酸溶液外,还需要选择的试剂最合理的是硫酸锰,提供锰离子,
故答案为:反应生成的锰离子起了催化作用;B;
(4)①反应开始时:c(KMnO4)=$\frac{0.001mol/L×0.004L}{0.004L+0.002L}$=0.00067 mol•L-1
反应时间:△t=$\frac{6min+7min+7min}{3}$=6.7min
KMnO4的平均反应速率:ν(KMnO4)=$\frac{0.00067mol/L}{6.7min}$=1×10-4 mol•L-1•min-1,
故答案为:1×10-4 mol•L-1•min-1;
②由题中数据知浓度大的褪色时间反而长,因颜色是由KMnO4产生,虽然KMnO4浓度大反应快,但KMnO4的量也多,故无法比较,故不经过计算直接利用表中的褪色时间长短来判断浓度大小与反应速率的关系是不可行的;所以若想通过直接观察褪色时间长短来判断溶液浓度的大小,则必须保证KMnO4酸性溶液的浓度相同,草酸过量且浓度不同,
故答案为:不可行;取过量的体积相同、浓度不同的草酸溶液分别与体积相同、浓度相同的高锰酸钾酸性溶液反应,观察溶液褪色的情况;
③只改变KMnO4酸性溶液的浓度,硫酸的用量相同,都是2.0mL,通过加蒸馏水使溶液总体积不变,总体积为10.0mL,则V1=3.0mL,V2=2.0mL,
故答案为:3.0;2.0.
点评 本题考查了探究影响化学反应速率的因素的方法,熟练掌握外界条件对化学反应速率的影响为解答关键,注意明确设置对照试验的原则,试题侧重考查学生的分析能力及化学实验能力,题目难度中等.

| A. | 丙烯 | B. | 1-丁烯 | C. | 丙炔 | D. | 2-丁炔 |
| A. | C2H5ClBr | B. | C3H6Cl2 | C. | C4H8Br2 | D. | C3H4I2 |
①CH3-CH=CH2和CH2=CH2的最简式相同
②丁二烯和丁烯为同系物
③标准状况下,11.2L的己烷所含的分子数为0.5NA (NA为阿伏加德罗常数)
④CH≡CH和C6H6含碳量相同
⑤正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法.
| A. | ①②⑥ | B. | ②③④ | C. | ②③⑥ | D. | ④⑤⑥ |
| A. | 6.4g 铜与S完全反应,电子转移0.1 NA个 | |
| B. | 标准状况下,2.24 L水中含有0.1 NA个水分子 | |
| C. | 1.12 L氯气中含有0.1 NA个氯原子 | |
| D. | 0.3molNO2与H2O反应转移的电子数为0.1NA |
| A. | 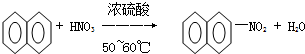 | |
| B. |  | |
| C. | CH3CHO+H2$→_{催化剂}^{高温高压}$CH3CH2OH | |
| D. | 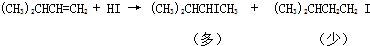 |
 ②Cl2
②Cl2 ③CO2
③CO2 ④H2O2
④H2O2 ⑤HClO
⑤HClO ⑥HCN
⑥HCN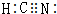
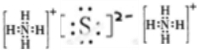 ⑧Ca(OH)2
⑧Ca(OH)2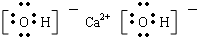 ⑨N2H4
⑨N2H4 ⑩CO(NH2)2
⑩CO(NH2)2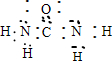 .
.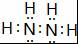 ;
;